(10分)Q W X Y Z是5种短周期元素 原子序数逐渐增大 Q与W组成的化合物是天然气的主要成分
| (10分)Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是天然气的主要成分,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1︰1和l︰2的两种离子化合物。 (1)W在元素周期表中的位置是 周期 族。 (2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料利用率是 。(填写序号)
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如右图所示,a极的电极反应是 。 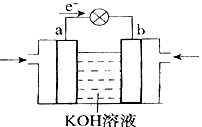 (5)已知:W(s)+Y2(g)=WY2(g); 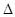 H=-393.5kJ/mol H=-393.5kJ/molWY(g)+ 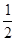 Y2(g)=WY2(g); Y2(g)=WY2(g);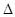 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式为 。 |
参考解答
| (1)第二周期、第ⅣA族。 (2)D (3)c(NO3-)>c( H+)>c(NH4+)>c(OH-) (4)CH4 – 8e- + 10OH- = CO32- + 7H2O (5)CO2、CO 1:8.24 (6)Na3N + 4H2O =' 3NaOH' + NH3.H2O |
| Q与W组成的化合物是天然气的主要成分,所以Q是H,W是C。机动车排出的大气污染物主要是碳的氧化物和氮的氧化物,因此X是N,Y是O。Y和Z能形成原子个数比为1︰1和l︰2的两种离子化合物,说明Z是钠元素。 (2)氨的合成是放热的、体积减小的可逆反应,升高温度,不利于平衡向正反应方向进行,催化剂不能平衡状态,将XQ3及时分离出去会降低反应速率,正确的答案是D。 (3)0.1molNH3和0.2molHNO3混合后,硝酸过量,溶液中含有的溶质是NH4NO3和HNO3,所以所得溶液中离子浓度从大到小的顺序是c(NO3-)>c( H+)>c(NH4+)>c(OH-)。 (4)根据电子的流动方向可知a是负极,应通入甲烷,所以a极的电极反应是CH4 – 8e- + 10OH- = CO32- + 7H2O。 (5)将所给的热化学方程式合并可得到W(s)+1/2Y2(g)=WY(g); 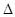 H=-155.5kJ/mol。 H=-155.5kJ/mol。因此24gC完全燃烧放出的热量是787kJ,不完全燃烧放出的热量是311 kJ,而实际放出362.5 kJ,所以产物是CO和CO2的混合物。根据十字交叉法可计算CO和CO2的物质的量之比是 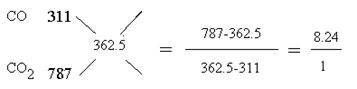 (6)X和Z分别是N和Na,其化合价分别是-3价和+1价,所以其化学式为Na3N,反应的方程式为Na3N + 4H2O =' 3NaOH' + NH3.H2O。 |
相似问题
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价) 有关该电池
新型NaBH4 H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )A.电极B材料中含MnO2层,MnO2可增强导
纽扣式银锌电池的构造示意图如图所示 电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag下
纽扣式银锌电池的构造示意图如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag下列说法不正确的是( )A.作负极,放电时Zn附近区域pH变大B.电子
如图装置所示 C D E F都是惰性电极 甲 乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变)
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F
根据图回答 下列说法正确的是( )A.若a为粗铜 b为纯铜 X为CuSO4 该装置可用于铜的精炼B
根据图回答,下列说法正确的是( )A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼B.若a为纯铁,b为纯铜,X为CuSO4该装置用于铁表面镀铜C.
下列图示与对应的叙述相符的是( )A.图5可以表示对某化学平衡体系改变温度后反应速率的变化
下列图示与对应的叙述相符的是()A.图5可以表示对某化学平衡体系改变温度后反应速率的变化B.图6可以表示乙酸溶液中通入氨气至过量过程中溶液导电性的












