如图装置所示 C D E F都是惰性电极 甲 乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变)
| 如图装置所示,C、D、E、F都是惰性电极, 甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积 不变),A、B为外接直流电源的两极.将直流电源接通后, F极附近呈红色.请回答: (1)B极是电源的______,一段时间后, 甲中溶液pH______(填“变大”、“变小”或“不变”). (2)若甲、乙装置中的C、D、E、F电极均只有一种单质 生成时,对应单质的物质的量之比为______. (3)现用丙装置给铜件镀银,则H应该是______(填“铜”或“银”),电镀液是______溶液;常温下当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为______克. (4)若将C电极换为银,其他装置都不变,则甲中发生总反应的离子方程式是______. 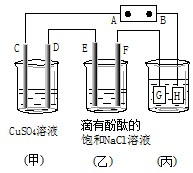 |
参考解答
| (1)将直流电源接通后,F极附近呈红色,说明F电极为阴极,阴极上氢离子放电导致F电极附近呈碱性,则C、E、G为阳极,D、F、H为阴极,阴极连接原电池负极,所以B是原电池负极;甲中阳极上OH-放电,阴极上Cu2+放电,导致溶液中c(H+)大于c(OH-),溶液呈酸性,所以溶液的pH变小; 故答案为:负极;变小; (2)C、D、E、F发生的反应分别为:4OH--4e-=2H2O+O2↑、Cu2++2e-=Cu、2Cl--2e-=Cl2↑、2H++2e-=H2↑,串联电路中转移电子相等,假设都转移4mol电子时,O2、Cu、Cl2、H2的物质的量分别是1mol、2mol、2mol、2mol,所以生成单质的物质的量之比为1:2:2:2,故答案为:1:2:2:2; (3)用丙装置给铜件镀银,镀层Ag为阳极,则G为Ag,镀件H为阴极,阴极材料是Cu,电镀液为AgNO3溶液,乙中电池反应式为2NaCl+2H2O
设生成0.05molNaOH转移电子的物质的量为x, 2NaCl+2H2O
2mol 2mol 0.05mol x 2mol:2mol=0.05mol:x x=
串联电路中转移电子相等,当转移0.05mol电子时,析出Ag的质量=
故答案为:铜;AgNO3;5.4g; (4)若将C换为Ag,则阳极上Ag失电子、阴极上Cu离子放电,电池反应式为2Ag+Cu2+
|
相似问题
根据图回答 下列说法正确的是( )A.若a为粗铜 b为纯铜 X为CuSO4 该装置可用于铜的精炼B
根据图回答,下列说法正确的是( )A.若a为粗铜,b为纯铜,X为CuSO4,该装置可用于铜的精炼B.若a为纯铁,b为纯铜,X为CuSO4该装置用于铁表面镀铜C.
下列图示与对应的叙述相符的是( )A.图5可以表示对某化学平衡体系改变温度后反应速率的变化
下列图示与对应的叙述相符的是()A.图5可以表示对某化学平衡体系改变温度后反应速率的变化B.图6可以表示乙酸溶液中通入氨气至过量过程中溶液导电性的
(16分)肼(N2H4)又称联氨 是一种可燃性液体 与氧气或氮氧化物反应均可生成氮气和水。氢气是一种
(16分)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。Ⅰ氢气的制取
某课外活动小组用右图进行实验 试回答下列问题.(1)若开始时开关K与a连接 则B极的电极反应式为__
某课外活动小组用右图进行实验,试回答下列问题.(1)若开始时开关K与a连接,则B极的电极反应式为______;(2)若开始时开关K与b连接,则B极的电极反应
下列关于如图所示的原电池的有关说法中 正确的是( )A.Zn是负极 发生还原反应B.Cu是负极 发
下列关于如图所示的原电池的有关说法中,正确的是( )A.Zn是负极,发生还原反应B.Cu是负极,发生氧化反应C.锌片上有气体逸出D.电子由锌片通过导












