【化学与技术】电镀厂镀铜废水中含有CN-和Cr2O72-离子 需要处理达标后才能排放。该厂拟定下列流
| 【化学与技术】 电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: 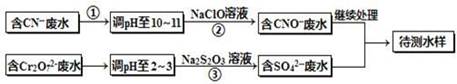 (1)上述处理废水流程中主要使用的方法是______。 (2)②中反应后无气体放出,该反应的离子方程式为 。 (3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。 (4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。 (5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
|
参考解答
| (1)氧化还原法 (2)CN-+ClO-=CNO-+Cl- (3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O (4)Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq) 因为:KSP(CuS)<KSP[Cu(OH)2 (5)D |
| (1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法; (2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-, (3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为: 3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。 (4)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq)。 (5)设最终生成了ymol混合物,由于Cr元素量不变,则有(2-x)y=2,Fe元素不变,则有(1-x)y=a,铁失去的电子物质的量等于Cr得到的电子的物质的量相等,有x=1.5,y=4,a=10。答案选D。 |
相似问题
下列各项操作中 不发生“先产生沉淀 然后沉淀又溶解”现象的是( )①向饱和碳酸钠溶液中通入过量的C
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是()①向饱和碳酸钠溶液中通入过量的CO2;②向硅酸胶体中逐滴加入过量的氢氧化钠溶液;③
根据相关化学原理 下列判断正确的是 [ ]A.若X是原子晶体 Y是分子晶体 则熔点:X
根据相关化学原理,下列判断正确的是 [ ]A.若X是原子晶体,Y是分子晶体,则熔点:X<YB.若KXO3+Y2===2KYO3+X2,则氧化性:Y2> X2 C.若R2- 和M+的
工业上利用锌焙砂(主要含ZnO ZnFe2O4 还含有少量CaO FeO CuO NiO等氧化物)制
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:(1)酸浸时ZnFe2O4会生成两
要使工业废水中的重金属离子Pb2+沉淀 可用硫酸盐 碳酸盐 硫化物等作沉淀剂。已知Pb2+与这些离子
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。已知Pb2+与这些离子形成的化合物的溶解度如下表:化合物PbSO4PbCO3PbS溶
A B C D四种无色溶液 它们分别是CH3COONa溶液 NH4Cl溶液 NaHSO4溶液和BaC
A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、NaHSO4溶液和BaCl2溶液中的一种,已知A、B溶液的pH相同,A、C混合后溶液变浑浊。下列说法












