在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状
| 在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状况如图所示. (1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是______. A.有、无催化剂 B.压强不同 C.温度不同 (2)写出该反应的化学平衡常数K的表达式______,并比较 K800℃______K850℃(填>、<或=). (3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2=______. (4)能说明该反应已达到平衡状态的是______. A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO) C.气体的平均摩尔质量不变 D.气体的密度保持不变. 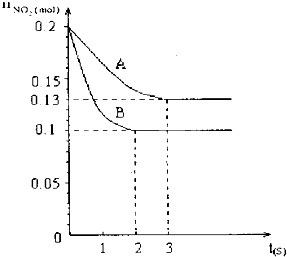 |
参考解答
| (1)由图象可知B状态反应较快,且A、B处于不同平衡状态,肯定不是催化剂的影响,如是压强的影响,则增大压强,平衡向逆反应方向移动,则NO2的物质的量应增大,但B状态NO2的物质的量较少,应是升高温度的原因,该反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则NO2的物质的量减少,故答案为:C; (2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
故答案为:k=
(3)根据图象可知,B状态时,平衡时NO2的物质的量为0.1mol,则反应的NO2的物质的量为0.1mol,生成O2的物质的量为0.05mol,则VO2=
故答案为:
(4)A.V正(NO2)=V逆(NO),说明正逆反应速率相等,反应达到平衡状态,故A正确; B.C(NO2)=C(NO),正逆反应速率不相等,没有达到平衡状态,故B错误; C.气体的质量不变,气体的平均摩尔质量不变,则说明气体的物质的量不变,说明反应达到平衡状态,故C正确; D.由于气体的质量不变,气体的体积不变,则无论是否达到平衡状态,都存在气体的密度保持不变的特征,不能判断是否达到平衡,故D错误. 故答案为:AC. |
相似问题
可逆反应N2+3H22NH3的正 逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反
可逆反应N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是( )A.3v正(N2)=v正(H2)B
在一定条件下 当可逆反应达到化学平衡时 下列说法错误的是[ ]A.正反应速率大于逆反应速率B
在一定条件下,当可逆反应达到化学平衡时,下列说法错误的是[ ]A.正反应速率大于逆反应速率B.正反应速率等于逆反应速率C.反应物的转化率达到最大 D
在一定温度下的恒容密闭容器中 能说明反应X2(g)+Y2(g)?2XY(g)已达到平衡的是( )A
在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)?2XY(g)已达到平衡的是( )A.容器内的总压不随时间变化B.容器中气体的平均相对分子质
在一定温度下 可逆反应2A(g)+B(g)C(g)+ D(g)达到平衡的标志是 [ ]A.
在一定温度下,可逆反应2A(g)+B(g)C(g)+ D(g)达到平衡的标志是 [ ]A.C的生成速率和B的消耗速率相等 B.v正( A)= 2v正( B) C.2v正( A)= v逆(B
在温度为373K时 将0.100mol无色的N2O4气体放入1L抽空的密闭容器中 立刻出现红棕色 直
在温度为373K时,将0 100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O42NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵












