在一恒温恒容密闭容器中 A B气体可建立如下平衡:2A(g)+2B(g)C(g)+3D(g)现分别从
在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g)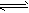 C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ. A、B的起始量均为2mol;Ⅱ. C、D的起始量分别为2mol和6mol。下列叙述不正确的是 C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ. A、B的起始量均为2mol;Ⅱ. C、D的起始量分别为2mol和6mol。下列叙述不正确的是 |
| [ ] |
| A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同 C.达到平衡时,途径Ⅰ和途径Ⅱ体系内混合气体平均相对分子质量相同 D.达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的1/2 |
参考解答
| B |
相似问题
下列说法中 正确的是 [ ]A.Kw随温度 浓度的改变而改变 B.凡是能自发进行的化学反应
下列说法中,正确的是 [ ]A.Kw随温度、浓度的改变而改变 B.凡是能自发进行的化学反应,一定是△H<0、△S>0 C.对已达到化学平衡的反应,改变压强
已知298K 101 kPa时 2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ/mo
已知298K,101kPa时,2SO2(g)+O2(g)2SO3(g) ΔH=-197kJ mol。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时,放出热量为Q1,向
Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下 当弱电解质达到电离平衡时 溶液中已电离的电
Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电
等温等容的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:
等温等容的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:I、反应由正反应方向开始,A和B的起始浓度均为2 mol L;II
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) 在673K 30MPa下 n(NH
对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )A.NH3在点












