Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下 当弱电解质达到电离平衡时 溶液中已电离的电
| Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。 |
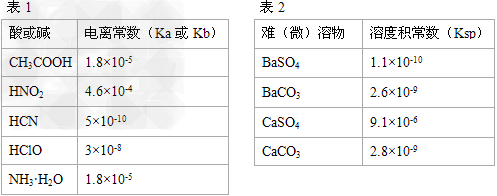 |
| 请回答下面问题: ⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。 A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 ⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。 ⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。 Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。 ⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。 2CO2(g)+6H2(g) 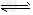 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 |
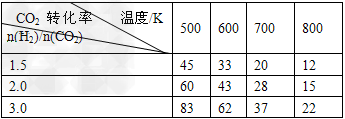 |
| 根据表中数据分析: ①上述反应的 a_______0(填“大于”或“小于”)。 ②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。 ⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示: |
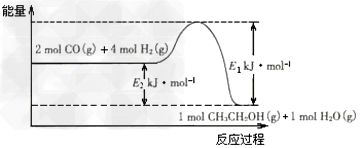 |
| ①写出CO和H2制备乙醇的热化学反应方程式_________________。 ②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、 12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。 ⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。 |
参考解答
| Ⅰ⑴B;⑵中性;水电离出的H+和OH-的浓度相等,CH3COONH4溶于水后,根据电离平衡常数,CH3COO-结合H+和NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+和 OH-浓度相等,呈中性;⑶0.24 Ⅱ⑴①小于;②不变;有利 ⑵①2CO(g)+4H2(g)  CH3CH2OH(g)+H2O(g) △H=-E2 kJ·mol-1; ②4Q<w<2E2 CH3CH2OH(g)+H2O(g) △H=-E2 kJ·mol-1; ②4Q<w<2E2⑶CH3OCH3-12e-+16OH-=2CO32-+ 11H2O |
相似问题
等温等容的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:
等温等容的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:I、反应由正反应方向开始,A和B的起始浓度均为2 mol L;II
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) 在673K 30MPa下 n(NH
对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )A.NH3在点
化学平衡常数(K) 电离常数( Ka) 溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关
化学平衡常数(K)、电离常数( Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是[ ]A.化学平衡常数的大小与
某温度下 2L密闭容器中加入4mol A和2mol B发生反应:3A(g)+2B(g)4C(l)+2
某温度下,2L密闭容器中加入4molA和2molB发生反应:3A(g)+2B(g)4C(l)+2D(g).平衡时测得n(C)=1 6mol.下列说法正确的是( )A.反应的化学
接触法制硫酸工艺中 其主反应在450℃并有催化剂存在下进行: (1)该反应所用的催化剂是______
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: (1)该反应所用的催化剂是_______(填写化合物名称),该反应450℃时的平衡常数______500












