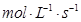在的可逆反应中 自反应开始至2 s末 氨的浓度由0变为0.4 则以氢气的浓度变化表示该反应在2 s
在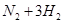  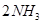 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 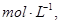 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
|
参考解答
| A |
试题分析:氨气的浓度增加了0.4mol/L,则根据方程式可知,消耗氢气的浓度是0.6mol/L,所以氢气的反应速率=0.6mol/L÷2s=0.3mol/(L·s),答案选A。 点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是明确反应速率的含义以及计算依据。另外该题也可以首先计算出氨气的反应速率,然后依据反应速率之比是相应的化学计量数之比直接进行换算即可。 |
相似问题
温度一定 在一个10L的密闭容器中 X Y Z三种物质的物质的量随时间的变化曲线如图所示。试根据图中
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。试根据图中数据,填写下列空白:(1)从开始至2min,Z的平均反
一定条件下 可逆反应N2 + 3H22NH3达到化学平衡状态 下列说法一定正确的是A.每1 mol
一定条件下,可逆反应N2 + 3H22NH3达到化学平衡状态,下列说法一定正确的是A.每1 mol N≡N断裂的同时有2 mol N—H生成B.N2、H2、NH3的浓度之比为
一定条件下 在2L密闭容器中加入某A气体8.0mol 在4s时测得A气体的物质的量为5.6mol 则
一定条件下,在2L密闭容器中加入某A气体8 0mol,在4s时测得A气体的物质的量为5 6mol,则此4s内用A表示该反应速率正确的是: ( )A.0 3 mol·L-1s-1B.
在10 L密闭容器中 1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)2C(气)
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气)2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mo
在稀硫酸与锌反应制取氢气的实验中 探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4 0mL,保持溶