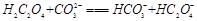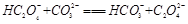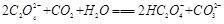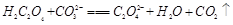草酸(H2C2O4)是二元弱酸 25℃时 H2C2O4:K1=5.4×10-2 K2=5.4×10-
| 草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。 (1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。 (2)下列化学方程式可能正确的是 。
①当V<10时,反应的离子方程式为______________________________________________。 ②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。 ③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。 ④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。 |
参考解答
| (1)酸 (2)BD (3)①H2C2O4+OH-=HC2O4-+H2O ②= > ③KHC2O4 = ④c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4) |
试题分析:(1)KHC2O4溶液是强碱弱酸盐所以显碱性。 (2)由25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。数据可知酸性强弱H2C2O4> HC2O4-> H2CO3> HCO3-。所以BD正确。 (3)因为H2C2O4是弱酸,分步电离氢离子,与碱反应时,先生成HC2O4-,然后再生成C2O42-,所以当V<10时,反应的离子方程式为H2C2O4+OH-=HC2O4-+H2O。 ②根据电荷守恒可知c(H+) +c(K+)=2c(C2O42-)+c(HC2O4-) +c(OH-)。若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则c(H+) =c(OH-)。 pH=7,V>10。 ③当溶液中有c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),根据物料守恒可知溶液中只有一种溶质KHC2O4,此时V=10,若酸过量或者碱过量或者生成K2C2O4,则上式均不成立。 ④当V=20时,,刚好反应生成K2C2O4,水解呈碱性。溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为c(C2O42-)>c(OH-)>c(HC2O4-)>c(H2C2O4)。 |
相似问题
给试管中某红色溶液加热 溶液颜色逐渐变浅 则原溶液可能是①滴有石蕊的NH4Cl溶液 ②滴有酚酞的氨水
给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是①滴有石蕊的NH4Cl溶液②滴有酚酞的氨水溶液③滴有石蕊的H2SO4溶液④滴有酚酞的饱和氢氧化钙
在0.1mol/L的氨水中存在 NH3·H2O NH4++OH-的电离平衡 下列措施都能使该平衡向
在0 1mol L的氨水中存在 NH3·H2O NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 ( )①加入少量HCl ②加入固体NaOH ③加水 ④通入
某化学兴趣小组在家中进行化学实验 按照图甲连接好线路发现灯泡不亮 按照图乙连接好线路发现灯泡亮 由此
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是()A.NaCl是非电解质B.N
用水稀释0.5mol·L—1的醋酸(CH3COOH)溶液 其中随水量的增加而增大的是:①H+的物质的
用水稀释0 5mol·L—1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是:①H+的物质的量 ②C(H+) ③C(H+) C( CH3COO—) ④C(CH3COOH) C(CH3C
常温下 pH=12的氨水中存在以下电离平衡: NH3·H2ONH4+ +OH-。往其中加入少量0.0
常温下,pH=12的氨水中存在以下电离平衡: NH3·H2ONH4+ +OH-。往其中加入少量0 01 mol·L-1NaOH溶液,保持不变的是( )A.c(NH4+)B.c(OH-)C.c(NH3·H2O)D.c(NH4+)·c(OH-)