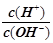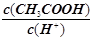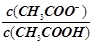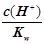一定温度下 用水稀释c mol·L-1的稀醋酸 若用KW表示水的离子积 则下列数值随水量的增加而增大
一定温度下,用水稀释c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是
|
参考解答
| C |
试题分析:A、稀释后溶液中c(H+)减小,c(OH–)增大,所以c(H+)和c(OH–)比值减小,故A错误;B、稀释能促进醋酸电离,n(H+)增加,n(CH3COOH)减小,所以n(H+):n(CH3COOH)减小,因在同一溶液中,c(H+):c(CH3COOH)也必然减小,故B错误;C、稀释过程中电离平衡常数Ka不变,即 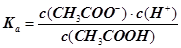 不变,而c(H+)减小,所以 不变,而c(H+)减小,所以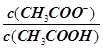 增大,故C正确;D、溶液中温度不变,水的离子积Kw不变,稀释后c(H+)减小,所以c(H+)和Kw的比值减小,故D错误。 增大,故C正确;D、溶液中温度不变,水的离子积Kw不变,稀释后c(H+)减小,所以c(H+)和Kw的比值减小,故D错误。 |
相似问题
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+ 要使溶液中c(H
已知0 1 mol L的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+) c(CH3COOH)值增大,可以采取的措施是()A.加少量烧碱溶液B.降低温
体积相同浓度均为0.1mol·L-1的NaOH溶液 氨水 分别稀释m倍 n倍 溶液的pH都变成9 则
体积相同浓度均为0 1mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m和n的关系正确的是A.m>nB.m=nC.m<nD.不能确定
对室温下pH 体积均相同的醋酸和盐酸溶液采取下列措施 有关叙述不正确的是A.使温度都升高20℃后 两
对室温下pH、体积均相同的醋酸和盐酸溶液采取下列措施,有关叙述不正确的是A.使温度都升高20℃后,两溶液的pH均不变B.加水稀释10倍后,两溶液的pH均增
已知:25℃ H2C2O4K1 = 5.4×10-2 K2 = 5.4×10-5;H2CO3 K1=
已知:25℃ H2C2O4K1 = 5 4×10-2,K2 = 5 4×10-5;H2CO3 K1=4 5×10-7,K2= 4 7×10-11;下列离子方程式一定不正确的是A.H2C2O4 +CO32-= HC
下列叙述正确的是A.相同条件下 等质量的硫蒸气和硫固体分别完全燃烧 前者放出的热量多B.2 L 0.
下列叙述正确的是A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多B.2 L 0 05 mol·L-1乙酸溶液中H+数为0 1NA(NA为阿伏加德