氢氟酸是一种弱酸 可用来刻蚀玻璃 已知25℃时:HF(aq) + OH—(aq) F—(aq) +
| 氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时: HF(aq) + OH—(aq) 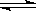 F—(aq) + H2O(l) △H=-67.7 kJ/mol F—(aq) + H2O(l) △H=-67.7 kJ/molH+(aq) + OH—(aq) 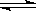 H2O(l) △H=-57.3kJ/mol H2O(l) △H=-57.3kJ/mol在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
|
参考解答
| C |
试题分析:C项:因为HF是弱酸,弱电解质,部分电离,当F-的水解程度等于多余的HF的电离程度时,可以出现c(Na+) = c(F—)。故错。故选C。 点评:本题考查的是盐类的水解的相关知识,强酸弱碱盐水解呈酸性,强碱弱酸盐水解呈碱性,另外需注意在溶液中会存在盐类的水解和弱电解质的电离都有的情况。 |
相似问题
向5 mL NaCl溶液中滴入一滴AgNO3溶液 出现白色沉淀 继续滴加一滴KI溶液并振荡 沉淀变为
向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述
已知AgI为黄色沉淀 AgCl为白色沉淀。25°C时 AgI饱和溶液中c(Ag+)为1.22×10-
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1 22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1 30×10-5mol·L-1。若在5 mL
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料 其煅烧产物为SO2和Fe3O4。(1)将0.0
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。(1)将0 050 mol SO2(g)和0 030 mol O2(g)放入容积为1 L的密闭容器中,
下列有关沉淀溶解平衡的说法中 正确的是( )A.在AgCl的沉淀溶解平衡体系中 加入蒸馏水 Ksp
下列有关沉淀溶解平衡的说法中,正确的是( )A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡
将一定量的碳酸钙放入水中 对此有关的叙述正确的是( )A.碳酸钙不溶于水 碳酸钙固体质量不会改
将一定量的碳酸钙放入水中,对此有关的叙述正确的是()A.碳酸钙不溶于水,碳酸钙固体质量不会改变B.最终会得到碳酸钙的极稀的饱和溶液C.因为Ca2++C












