黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料 其煅烧产物为SO2和Fe3O4。(1)将0.0
| 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。 (1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g) 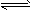 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。 (2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高 SO2平衡转化率的有________(填字母) (A)升高温度 (B)降低温度 (C)增大压强 (D)减小压强 (E)加入催化剂 (G)移出氧气 (3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为_________________________________。 (4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是_______________________。 |
参考解答
(1)解: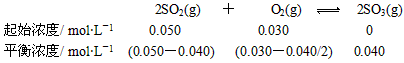 所以,K 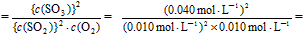 1.6×103 mol·L-1。 1.6×103 mol·L-1。二氧化硫的转化率 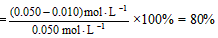 |
| (2)BC (3)SO2+H2O+Na2SO3=2NaHSO3 (4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+ |
相似问题
下列有关沉淀溶解平衡的说法中 正确的是( )A.在AgCl的沉淀溶解平衡体系中 加入蒸馏水 Ksp
下列有关沉淀溶解平衡的说法中,正确的是( )A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡
将一定量的碳酸钙放入水中 对此有关的叙述正确的是( )A.碳酸钙不溶于水 碳酸钙固体质量不会改
将一定量的碳酸钙放入水中,对此有关的叙述正确的是()A.碳酸钙不溶于水,碳酸钙固体质量不会改变B.最终会得到碳酸钙的极稀的饱和溶液C.因为Ca2++C
常温时 下列关于电解质溶液的叙述正确的是[ ]A.稀释pH=10的氨水 溶液中所有离子的浓度
常温时,下列关于电解质溶液的叙述正确的是[ ]A.稀释pH=10的氨水,溶液中所有离子的浓度均降低B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 C.
已知:Ksp(AgCl)=1.8×10-10 Ksp(AgI)=1.5×10-16 Ksp(Ag2C
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )A.AgCl
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案 其流程图如下:(所用石灰石含有杂质SiO
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)回答下列问题:(1)充分煅烧110吨石灰石得到












