为探索工业含铝 铁 铜合金废料的再利用 甲同学设计的实验方案如下:请回答:(1)操作①用到的玻璃仪器
| 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: |
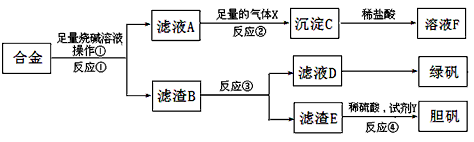 |
| 请回答: (1)操作①用到的玻璃仪器有 ______________。 (2)写出反应①的化学方程式___________ , 反应②的离子反应方程式 _____________。 (3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)_______________。 (4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是__________________ 。 (5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是_______________ ,将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是____________ 。 (6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见表(设硝酸的还原产物只有NO)。 |
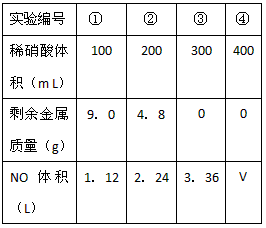 |
| 试通过计算填空: I.硝酸的浓度为 ______________; II.③中溶解铜的质量为 ________________; III.④中V=_____________ L。 |
参考解答
| (1)烧杯、漏斗、玻璃棒 (2)2Al + 2NaOH + 2H2O== 2NaAlO2+ 3H2↑ ;AlO2- + CO2 + 2H2O==Al(OH)3↓+ HCO3- (3)取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀变成灰绿色最后变成红褐色。 (4)Cu + H2O2 + H2SO4 + 3H2O == CuSO4·5H2O或Cu+H2O2 + H2SO4 == CuSO4 + 2H2O (5)铁粉与杂质铜形成原电池反应,加快了反应速率 ;因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解平衡右移,因此得不到FeCl3·6H2O晶体 (6)2mol/L; 4.8g; 4.48L |
相似问题
某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中 出现了白色浑浊
某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中,出现了白色浑浊物。 ⑴实验小组的同学查阅了工具书上的相关数据,经
阅读分析材料 完成下列各题: 某同学做同主族元素性质的相似性 递变性实验时 自己设计了一套实验方案
阅读分析材料,完成下列各题: 某同学做同主族元素性质的相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的 “实
某化学兴趣小组欲研究一种镁铝合金 以下是部分实验。请完成填空。 【实验一】从镁铝合金片上剪下一小块
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。 【实验一】从镁铝合金片上剪下一小块,先称重,然后投到盛有10 mL 10 mol·L-1 N
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的 用于探究工业上为何采用98.3%的浓硫酸吸收三氧
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98 3%的浓硫酸吸收三氧化硫。 请回答下列问题:(1)写出沸腾炉内煅烧黄铁
下图是探究铜丝与过量浓硫酸的反应下列叙述不正确的是[ ]A.上下移动①中铜丝可控制SO2的量
下图是探究铜丝与过量浓硫酸的反应下列叙述不正确的是[ ]A.上下移动①中铜丝可控制SO2的量 B.②中品红溶液褪色 C.③中石蕊溶液变红色 D.为确认Cu












