红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).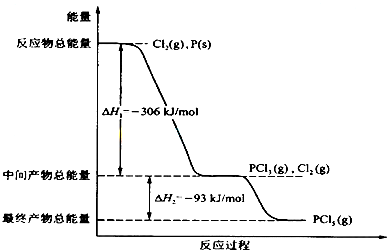 根据上图回答下列问题: (1)P和Cl2反应生成PCl3的热化学方程式______. (2)PCl5分解成PCl3和Cl2的热化学方程式______,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2______α1(填“大于”、“小于”或“等于”). (3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______. (4)P和Cl2分两步反应生成1molPCl5的△H3=______. |
参考解答
(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为:P(s)+
故答案为:P(s)+
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g);△H=+93 kJ/mol, PCl5分解率α1=
故答案为:PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1;25%;大于; (3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成, 故答案为:两步反应均为放热反应,降低温度有利于提高产率,防止产物分解; (4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式: P(s)+
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol; P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol, 故答案为:-399kJ?mol-1. |
相似问题
运用化学反应原理研究氮 硫 氯 碘等单质及其化合物的反应有重要意义.(1)硫酸生产中 SO2催化氧化
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系
用CH4催化还原NOX可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOX可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1②CH4(g)+4NO(g)=2N2(g)+CO2
(1)在25℃下 向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水 先生
(1)在25℃下,向浓度均为0 1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25
下列说法正确的是( )A.中和相同体积 相同pH的①硫酸 ②盐酸和③醋酸所需相同浓度的NaOH溶液
下列说法正确的是( )A.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3B.已知难溶物FeS的Ksp=8 1×10
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol分析下列说法中正
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297 23kJ mol分析下列说法中正确的是( )A.S(g)+O2(g)=SO2(g)|△H|>297 23kJ molB.S(g)+












