运用化学反应原理研究氮 硫 氯 碘等单质及其化合物的反应有重要意义.(1)硫酸生产中 SO2催化氧化
| 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 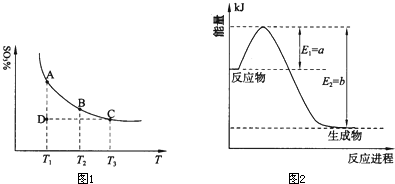 ①2SO2(g)+O2(g)?2SO3(g)的△H______0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡______移动(填“向左”、“向右”或“不”); ②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1______K2;若反应进行到状态D时,v正______v逆(填“>”、“<”或“=”) (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用. ①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______.(△H的数值用含字母a、b的代数式表示) ②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4)______c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式______. (3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L-1的NaCl溶液中逐滴加入适量的0.1mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是______,向反应后的浊液中,继续加入0.1mol?L-1的NaI溶液,看到的现象是______,产生该现象的原因是(用离子方程式表示)______. (已知25°C时Ksp[AgCl]=1.0×10-14mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2) |
参考解答
| (1))①由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应,即△H<0; 恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动. 故答案为:<;向左; ②温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,故K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆, 故答案为:>;>; (2)①由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1, 故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1; ②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(H+)=c(OH-),故c(NH4+)=c(Cl-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
故答案为:=,
(3)由于离子积Qc大于溶度积Ksp(AgCl),平衡向生成AgCl沉淀的方向移动,故AgCl沉淀生成, 两者化学式所表示的阴阳离子个数比相同,溶度积越大,溶解性越大,即AgCl比AgI的溶解度大,物质由溶解度大的转化为溶解度更小的,所以由AgCl转化为更难溶的AgI,现象为白色沉淀转化为黄色沉淀,离子方程式为AgCl(s)+I-═AgI(s)+Cl-, 故答案为:离子积Qc大于溶度积Ksp(AgCl);白色沉淀转化为黄色沉淀;AgCl(s)+I-═AgI(s)+Cl-. |
相似问题
用CH4催化还原NOX可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)=4NO(g)+C
用CH4催化还原NOX可以消除氮氧化物的污染.例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1②CH4(g)+4NO(g)=2N2(g)+CO2
(1)在25℃下 向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水 先生
(1)在25℃下,向浓度均为0 1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25
下列说法正确的是( )A.中和相同体积 相同pH的①硫酸 ②盐酸和③醋酸所需相同浓度的NaOH溶液
下列说法正确的是( )A.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3B.已知难溶物FeS的Ksp=8 1×10
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol分析下列说法中正
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297 23kJ mol分析下列说法中正确的是( )A.S(g)+O2(g)=SO2(g)|△H|>297 23kJ molB.S(g)+
已知有热化学方程式:SO2(g)+12O2(g)═SO3(g)△H=-98.32kJ/mol现有4m
已知有热化学方程式:SO2(g)+12O2(g)═SO3(g)△H=-98 32kJ mol现有4molSO2参加反应,当放出314 3kJ热量时,SO2的转化率最接近于( )A.40%B.50%C.80%D.90%












