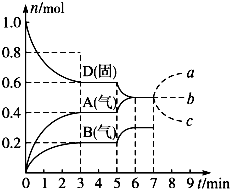
在容积为2.0L的密闭容器内 物质D在T℃时发生反应 其反应物和生成物的物质的量随时间t的变化关系如
| 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题: (1)从反应开始到第一次达到平衡时,A物质的平均反应速率为______mol?(L?min)-1. (2)根据上图写出该反应的化学方程式______,该反应的平衡常数表达式为K=______. (3)第5min时,升高温度,A、B、D的物质的量变化如上图,则该反应的正反应是______(填“放热”或“吸热”)反应,反应的平衡常数______(填“增大”“减小”或“不变”,下同),B的反应速率______. (4)若在第7min时增加D的物质的量,A的物质的量变化正确的是______(用图中a、b、c的编号回答). (5)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总压强为原来的
 |
参考解答
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
故答案为:0.067; (2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol, △A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g); 故答案为:2D(s)?2A(g)+B(g) 因D为固体,所以化学平衡常数K=C2(A)×C(B), 故答案为:K=C2(A)×C(B); (3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应, 平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大; 温度升高化学反应B的反应速率加快; 故答案为:吸热;增大;增大; (4)D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b; (5)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总压强为原来的
N2+3H2=2NH3 起始量(mol) 1 3 0 变化量(mol) x 3x 2x 平衡量(mol) 1-x 3-3x 2x 气体的总压强为原来的
x=0.2mol 则N2的转化率α(N2)=
故答案为:20%. |
相似问题
下列各表述与示意图一致的是[ ]A.图①表示25℃时 用0.1 mol/L盐酸滴定20 mL
下列各表述与示意图一致的是[ ]A 图①表示25℃时,用0 1mol L盐酸滴定20mL0 1mol LKOH溶液,溶液的pH随加入酸体积的变化B 图②中曲线表示反应N2(g)+3H2(
(1)在一定温度下 有下列反应发生:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)①该
(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)①该反应的平衡常数表达式K=______.②该温度下,在2L盛有Fe2O3粉末的密闭
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后 联系化工生产实际所发表的看法 你认为不
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是[ ]A.化学反应速率理论可指导怎样在
现有三个反应:反应① Fe(s)+H2O(g)FeO(s)+H2(g) △H1 平衡常
现有三个反应:反应①Fe(s)+H2O(g)FeO(s)+H2(g) △H1平衡常数为K1 反应②CO(g)+H2O(g)H2(g)+CO2(g) △H2平衡常数为K2 反应③Fe(s)+CO2(g)FeO(s)+CO(g
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中 发生反应:2SO2+O2
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:2SO2+O22SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器












