可逆反应A(?)+aB(g) C(g)+D(g) 其中a为正整数。反应过程中 当其他条件不变时 C的
可逆反应A(?)+aB(g)  C(g)+D(g),其中a为正整数。反应过程中,当其他条件不 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。试回答下列问题: 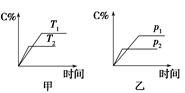 (1)化学方程式中a= ,反应物A的状态是 。 (2)该反应的焓变值ΔH (填“>”或“<”)0,在不改变其他条件的情况下增加B的物质的量,平衡 (填“正”或“逆”)向移动,平衡常数K (填“增大”、“减小”或“不变”)。 |
参考解答
| (1)1 非气态 (2)< 正 不变 |
| (1)由乙图可以确定p2>p1,加压时C%减小,平衡逆向移动,故气体反应物的计量数之和小于气体产物的计量数之和,若A为气体,1+a≥1+1,故A为非气体,且a=1。 (2)由甲图可以确定T1<T2,温度升高,C%减小,说明正反应是放热反应,ΔH<0;在不改变其他条件的情况下增加B的物质的量,平衡正向移动,没有改变温度,平衡常数K不变。 |
相似问题
将4mol A气体和2mol B气体在2L的密闭容器内混合 并在一定条件下发生如下反应:2A(g)+
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0 6mol·L-1,现有下列几种说法
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g)2NH3(g) Δ
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g)2NH3(g) ΔH=-92 4 kJ mol。在500 ℃、20 MPa时,将N2、H2置于一
如图是可逆反应X2+3Y22Z2在反应过程中的反应速率V与时间(t)的关系曲线 下列叙述正确的是A.
如图是可逆反应X2+3Y22Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是A.t1时,只有正方向反应B.t2时,反应到达限度C.t2-t3,反
在密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH
在密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是() A.
下列事实不能用勒夏特列原理解释的是[ ]A.温度控制在500℃有利于合成氨反应 B.实验室中
下列事实不能用勒夏特列原理解释的是[ ]A.温度控制在500℃有利于合成氨反应 B.实验室中常用排饱和食盐水的方法收集Cl2 C.将相同体积、相同pH盐酸与












