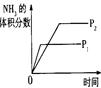
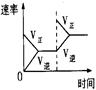
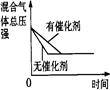
可逆反应N2 (g)+3H2(g) 2NH3(g) △H<0 下列研究目的和示意图相符的是(
可逆反应N2 (g)+3H2(g)  2NH3(g) △H<0,下列研究目的和示意图相符的是( ) 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
|
参考解答
| C |
试题分析:A、对于上述合成氨反应,增大压强平衡向正反应方向移动,则NH3的体积分数增大,与图像一致,但压强增大,化学反应速率加快,到达化学平衡的时间缩短,与图像不符,错误。B、该反应是放热反应,升高温度化学平衡向逆反应方向移动,则N2的转化率降低,图像中N2的转化率随着温度升高而增大,两者不相符,错误。C、反应达到平衡后,增加N2的量,增加N2的瞬间正反应速率增大,逆反应速率不变,然后正反应速率不断减小,逆反应速率不断增大,直到新的平衡,与图像符合,正确。D、催化剂对化学平衡状态无影响,但催化剂能加快化学反应速率,所以有催化剂时达到化学平衡的时间较短,与图像不符,错误。 |
相似问题
在体积为V L的恒容密闭容器中盛有一定量H2 通入Br2(g)发 生反应:H2(g)+Br2(g)
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(
某温度下 在一体积不变的密闭容器中充入1molN2O4气体 达到平衡后 再充入1mol N2O4气体
某温度下,在一体积不变的密闭容器中充入1molN2O4气体,达到平衡后,再充入1molN2O4气体,下列说法中错误的是( )A.平衡向生成NO2的方向移动B.新平
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得C
一定温度下 将3molA气体和1molB气体通过一密闭容器中 发生如下反应: 3A(g)+B (g
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应: 3A(g)+B (g)xC(g)。若容器体积固定为2L,反应1min时测得剩余1 8molA,C的浓度为
向某密闭容器中加入0.3 mol A 0.1 mol C和一定量的B三种气体。一定条件下发生反应 各
向某密闭容器中加入0 3 mol A、0 1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]