将CO2转化为甲醇的原理为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) 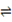 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是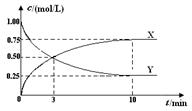
|
参考解答
| D |
A、正确,X浓度增大,是生成物,X可以表示CH3OH(g) 或H2O(g) 的浓度变化;B、正确,H2的反应速率v(H2)=(0.75mol/L×3)/10min=0.225mol/(L﹒min);C、正确,平衡时H2的转化率为0.75mol×3/3mol×100%=75%; D、不正确,500 ℃时该反应的平衡常数K=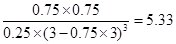 ;选D。 ;选D。 |
相似问题
一定温度下 将3molA气体和1molB气体通过一密闭容器中 发生如下反应: 3A(g)+B (g
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应: 3A(g)+B (g)xC(g)。若容器体积固定为2L,反应1min时测得剩余1 8molA,C的浓度为
向某密闭容器中加入0.3 mol A 0.1 mol C和一定量的B三种气体。一定条件下发生反应 各
向某密闭容器中加入0 3 mol A、0 1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]
二甲醚是一种清洁燃料 以n(H2)/n(CO)=2通入1L的反应器中 一定条件下发生反应:2CO(g
二甲醚是一种清洁燃料,以n(H2) n(CO)=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强
某密闭容器中发生如下反应 X(g)+3Y(g)2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化
某密闭容器中发生如下反应 X(g)+3Y(g)2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改
下列叙述中 不能用平衡移动原理解释的是 [ ]A.红棕色的NO2 加压后颜色先变深后变浅 B
下列叙述中,不能用平衡移动原理解释的是 [ ]A.红棕色的NO2,加压后颜色先变深后变浅 B.高压比常压有利于合成SO3的反应 C.由H2、I2(g)、HI(g)气体












