工业上以黄铜矿为原料 采用火法熔炼工艺生产粗钢。(1)该工艺的中间过程会发生反应:2Cu2O+Cu2
| 工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。 (1)该工艺的中间过程会发生反应:2Cu2O+Cu2S  6Cu+SO2↑,反应的氧化剂是 。 6Cu+SO2↑,反应的氧化剂是 。(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO4溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。 实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的 极相连,阴极上的电极反应式为 。 实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学参考下表的数据,设计了如下方案:  试剂a是 (填化学式),其目的是 ;该方案能够除去的杂质离子是 (填离子符号)。 实验三 电解后溶液离子含量的测定 乙同学设计了如下方案: 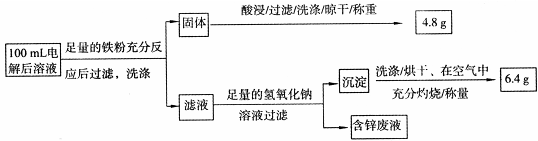 则100mL溶液中Cu2+的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1。 |
参考解答
| (14分) (1)Cu2O 、Cu2S (2分); (2)正(1分) Cu2++2e-= Cu(2分) H2O2(2分)将Fe2+氧化成Fe3+(2分) Fe2+ (2分) 0.75(2分)0.05(2分) |
试题分析: (1)反应中Cu2O 、Cu2S的Cu均从+1→0价,所以反应的氧化剂Cu2O 、Cu2S。 (2)精炼铜时粗铜做阳极与电源的正极相连,电极反应:Cu2++2e-= Cu。根据流程中调节pH到4可知三价铁沉淀,试剂a是氧化剂,将Fe2+氧化成Fe3+,除去Fe2+。固体为铁和铜的混合物,酸处理后的4.8g为铜,n(Cu)=4.8/64g/mol=0.075mol,c(Cu2+)=0.75 mol·L-1;根据题意生成m(Fe2O3)=6.4g,n(Fe2O3)=6.4g/160g/mol=0.04mol,得n(Fe)=0.08mol;其中来自与硫酸铜的置换反应的为0.075mol,所以原溶液中n(Fe)=0.005mol,Fe2+的浓度为0.05 mol·L-1。 |
相似问题
(8分)在用惰性电极电解水制取H2和O2时 为了增强导电性 常常要加入一些电解质 下列物质中不能选用
(8分)在用惰性电极电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列物质中不能选用的是(填序号)A.NaOH B.H2SO4C.Na2SO4D.C
如图 A池用石墨电极电解NaOH溶液 B池精炼粗铜 一段时间后停止通电 A池中D极产生具有氧化性的气
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2 24L。下列说法正确的是()A.A池溶
(6分)电解原理在化学工业上有着广泛的应用。图中电解池a为电解液 X和Y是两块电极板。则:(1)若X
(6分)电解原理在化学工业上有着广泛的应用。图中电解池a为电解液,X和Y是两块电极板。则:(1)若X和Y均为惰性电极,a为饱和的NaCI溶液,则电解时检验Y电
(20分)氯碱工业中电解饱和食盐水的原理示意图 如图所示:(1)溶液A的溶质是
(20分)氯碱工业中电解饱和食盐水的原理示意图,如图所示:(1)溶液A的溶质是;(2)电解饱和食盐水的离子方程式是;(3)电解时用盐酸控制阳极区溶液
(14分)电解原理在化学工业中有广泛应用。下图表示一个电解池 装有电解液a ;X Y是两块电极板 通
(14分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、












