(14分)下列物质中 ①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;
| (14分)下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答) ⑴是弱电解质的有 ,是非电解质的有 。 ⑵pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是 。 ⑶有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。 (4)某温度时,0.01 mol?L-1的醋酸溶液电离平衡常数为1. 0×10 -8,醋酸的电离平衡常数表达式为 ,达平衡时,溶液中氢离子浓度是 ,当向该溶液中加入一定量的盐酸时,电离常数 发生变化(填是、否)。 (5)将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入了水与NaOH溶液的体积比为 。 |
参考解答
| ⑴③⑥,⑨;⑵③;⑶ ④⑦⑧,a﹤b=c。 (4) K= 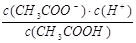 ,4.18×10 -4 mol?L-1 ,否。 (5)11:1 ,4.18×10 -4 mol?L-1 ,否。 (5)11:1 |
| (1)弱电解质包括:弱酸、弱碱、水、极个别的盐;④CH3COOH溶液是混合物,故不属于弱电解质; (2)NaOH是强碱,完全电离,NH3·H2O是弱碱,部分电离,且存在NH3·H2O的电离平衡;加水稀释相同倍数后,NH3·H2O的电离平衡正向移动,故[OH-:NH3·H2O>NaOH,所以,pH大的是③NH3·H2O; (3)④CH3COOH是弱酸 ⑦HCl是一元强酸 ⑧H2SO4是二元强酸,三者PH相等,即自由移动的H+浓度相等,则物质的量浓度大到小的顺序为:CH3COOH(c>0.01mol.L-1)>HCl(c=0.01mol.L-1)>H2SO4(c=0.005mol.L-1); 对HCl、H2SO4,均是:H+ + OH- = H2O 1 1 则中和含等物质的量NaOH的溶液时,[H+HClb=[H+H2SO4c,因为[H+HCl=[H+H2SO4,所以b=c, CH3COOH +NaOH= CH3COONa+H2O ,则c(CH3COOH)a =等物质的量NaOH,而c(CH3COOH) >[H+HCl=[H+H2SO4,所以a<b=c; (4) CH3COOH 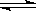 CH3COO-+H+ CH3COO-+H+ C0 0.01 0 0 △C x x x C(平衡) 0.01-x x x 则:x2/( 0.01-x)= 1.0×10 -8,得:[H+=' x' =4.18×10 -4 mol?L-1 平衡常数仅受温度影响,故加入一定量的盐酸时,电离常数不发生变化; (5)PH由1变到2,即H+浓度由0.1mol?L-1变到0.01mol?L-1, 第一份加水:0.01mol?L-1=[0.1×V(HCl)/[ V(HCl)+V(H2O),得:V(H2O)=9V(HCl), 第二份加碱:0.01mol?L-1=[0.1×V(HCl)- 0.1×V(NaOH)/[ V(HCl)+V(NaOH),得:V(NaOH)=9/(11V), 所以:V(H2O):V(NaOH)= 11:1 |
相似问题
回答下列问题: (1)有一种溶液除H+ OH-外 还有Na+ SO42-和Cl- 测得三种离子的浓度
回答下列问题: (1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0 01 mol·L-1、0 0035 mol·L-1和0 004 mol·L-1,该溶液
醋酸是一种常见的弱酸 为了证明醋酸是弱电解质 某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是 (
(1)某温度(t℃)时 水的离子积为Kw=1×10-13 则该温度 25℃(填“>”“=”或“<”
(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mo
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸 请回答下列问题:(1)若分别将pH
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸醋酸(填
下列物质的稀溶液中 溶质的阴 阳离子个数之比为1∶2的是A.Na2HPO4B.NaHSO4C.(NH
下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是A.Na2HPO4B.NaHSO4C.(NH4)2SO4D.K2S












