(1)某温度(t℃)时 水的离子积为Kw=1×10-13 则该温度 25℃(填“>”“=”或“<”
| (1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度 25℃(填“>”“=”或“<”),在此温度下,某溶液中由水电离出来的H+浓度为1×10-10mol/L,则该溶液的pH可能为 或 。 若温度为25℃时,体积为Va、pH=a的H2SO4溶液与体积为Vb、pH=b的NaOH溶液混合,恰好中和.已知Va>Vb,且a=0.5 b,则a的取值范围 。 (3)若将此温度(t℃)下,pH=11的苛性钠溶液m L与pH=1的稀硫酸溶液nL混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。 ①若所得混合液为中性,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。 ②若所得混合液的pH=2,则m∶n= ;此溶液中各种离子的浓度由大到小排列顺序是 。 |
参考解答
(1)> 10 3(每空1分) (2) 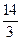 <a<7(2分) <a<7(2分)(3) ①10∶1(2分) c(Na+)>c(SO)>c(H+)=c(OH-) (全对得2分) ②9∶2(2分) c(H+)>c(SO)>c(Na+)>c(OH-) (全对得2分) |
略 |
相似问题
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸 请回答下列问题:(1)若分别将pH
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸醋酸(填
下列物质的稀溶液中 溶质的阴 阳离子个数之比为1∶2的是A.Na2HPO4B.NaHSO4C.(NH
下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是A.Na2HPO4B.NaHSO4C.(NH4)2SO4D.K2S
常温下 甲 乙两杯醋酸稀溶液 甲的pH=a 乙的pH=a+1 下列叙述的判断正确的是
常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列叙述的判断正确的是()A.甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质
(8分)在一定温度下 有a. 醋酸 b.硫酸 c.盐酸三种酸:(1)当三种酸物质的量浓度相同时 三种
(8分)在一定温度下,有a 醋酸 b.硫酸 c.盐酸三种酸:(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是用a、b、c表示,下同
在H2S的饱和溶液中存在下列平衡 ①H2SH++HS-②HS-H++S2- 且知K1>K2 采取下
在H2S的饱和溶液中存在下列平衡 ①H2SH++HS-②HS-H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是(












