由碳的氧化物直接合成乙醇燃料已进入大规模生产.如图是由二氧化碳合成乙醇的技术流程:吸收池中盛有饱和碳
由碳的氧化物直接合成乙醇燃料已进入大规模生产.如图是由二氧化碳合成乙醇的技术流程: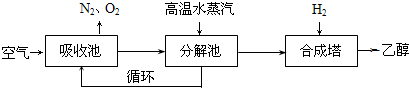 吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇. 回答下列问题: (1)写出吸收池中反应的离子方程式______. (2)从分解池中循环使用的物质是______. (3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为: 2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g) 请写出该反应的化学平衡常数表达式K=______. (4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数.则由CO制取CH3CH2OH的优点是______, 由CO2制取CH3CH2OH的优点是______.(写出一点即可) (5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
①温度升高,该反应的平衡常数K值______(选填“增大”、“减小”或“不变”). ②提高氢碳比(
|
参考解答
| (1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHO3,反应离子方程式为CO2+CO32-+H2O=2HCO3- . 故答案为:CO2+CO32-+H2O=2HCO3-. (2)由工艺流程转化关系可知,分解池中KHO3分解生成K2CO3,碳酸钾在被循环利用吸收空气中二氧化碳. 故答案为:K2CO3. (3)2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)的平衡常数k=
故答案为:
可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是常数,用K表示,这个常数叫化学平衡常数. (4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数,则由CO制取CH3CH2OH,原料有较大的转化率;碳酸钾溶液吸收空气中的二氧化碳,转化为KHO3,KHO3分解生成CO2,CO2原料易得. 故答案为:原料有较大的转化率;CO2原料易得. 由题目信息可知,CO制取CH3CH2OH的,原料有较大的转化率;由工艺流程可知,CO2原料易得. (5)①由表中数据可知,n(H2)/n(CO2)一定情况下,温度越高,CO2转化率越低,说明升高温度平衡向逆反应移动,所以平衡常数k减小. 故答案为:减小. ②由表中数据可知,温度一定时,n(H2)/n(CO2)越大,CO2转化率越高,有利于CH3CH2OH生成. 故答案为:有利. |
相似问题
一密闭体系中发生下列反应:(正反应放热)。下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列
一密闭体系中发生下列反应:(正反应放热)。下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题(1)处于非平衡状态的时间段是____________
373K时 某1L密闭容器中加入1molPCl5发生如下可逆反应:PCl5 (g)PCl3(g)+C
373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:PCl5(g)PCl3(g)+Cl2(g).其中物质PCl3的物质的量变化如右图所示.(1)前20s内PCl5(g)的
试运用所学知识 解决下列问题:(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体
试运用所学知识,解决下列问题:(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下
对化学反应限度的叙述 错误的是[ ]A.任何可逆反应都有一定的限度 B.化学反应达到限度时
对化学反应限度的叙述,错误的是[ ]A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正逆反应速率相等 C.化学反应的限度与时间的长短无关 D
在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO NOx 碳氢化合物)相互反应生成无毒害物质
在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。(1)N2(g)+O2(g)=2NO(g)△H=












