试运用所学知识 解决下列问题:(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体
| 试运用所学知识,解决下列问题: (1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol?L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线. (3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式______. 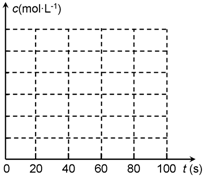 |
参考解答
(1)对于反应 CO(g)+H2O(g)  H2(g)+CO2(g), 开始(mol/L):0.02 0.02 0 0 变化(mol/L):c c c c 平衡(mol/L):0.02-c 0.02-c c c 所以
所以CO的转化率为
故答案为:75%. (2)①由表可知,60s时反应达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4, 根据反应方程式计算: 2NO2 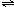 N2O4 初始:0.4mol 0 转化:0.16mol 0.08mol 平衡:0.24mol 0.08mol 则平衡时的浓度分别为:c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L, 所以该温度下该反应平衡常数k=
故答案为:=; 2.8 ②根据反应 2NO2 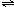 N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
根据反应 2NO2 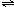 N2O4可知,NO2的浓度随时间变化为N2O4的浓度变化2倍.从放入N2O4到平衡时需要80s,初始加入的N2O4的物质的量浓度为0.1mol/L,平衡时N2O4的物质的量浓度为0.04mol/L,NO2的物质的量浓度为2×(0.1mol/L-0.04mol/L)=0.12mol/L,图象可取起点、20s、80s等几个点用平滑曲线来连接. 故答案为: 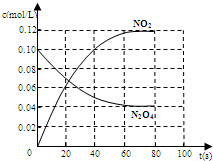 (3)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-. 故答案为:O2+2H2O+4e-=4OH-. |
相似问题
对化学反应限度的叙述 错误的是[ ]A.任何可逆反应都有一定的限度 B.化学反应达到限度时
对化学反应限度的叙述,错误的是[ ]A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正逆反应速率相等 C.化学反应的限度与时间的长短无关 D
在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO NOx 碳氢化合物)相互反应生成无毒害物质
在汽车上安装催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)相互反应生成无毒害物质,减少汽车尾气污染。(1)N2(g)+O2(g)=2NO(g)△H=
下列有关平衡常数的说法中 正确的是 [ ]A.改变条件 反应物的转化率增大 平衡常数也一定增
下列有关平衡常数的说法中,正确的是[ ]A.改变条件,反应物的转化率增大,平衡常数也一定增大 B.反应2NO2(g)N2O4(g) △H<0,升高温度该反应平衡常
对化学反应限度的叙述 错误的是 [ ]A.任何可逆反应都有一定的限度B.化学反应的限度是不可
对化学反应限度的叙述,错误的是 [ ]A.任何可逆反应都有一定的限度B.化学反应的限度是不可改变的 C.化学反应的限度与反应速率无关D.化学反应达到
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)现在容积均为1L
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1molC0和2molH2的混合气体,控制温












