碘在水中溶解度很小 但易溶于KI溶液 因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
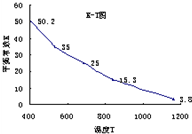 |
参考解答
A、由图象曲线的变化趋势可知,当温度升高时,I3-的物质的量浓度减小,说明该反应的正反应为放热反应,反应I2(aq)+I-(aq) I3-(aq)的△H<0,故A正确; B、因为发生反应:I2(aq)+I-(aq)=I3-.增大了碘的溶解度,所以配制碘水加入少量碘化钾,当消耗碘单质时平衡左移又生成碘单质,故B正确; C、硫不溶于KI溶于,碘在水中溶解度很小,但易溶于KI溶液,因此可以分离,故C正确; D、苯会萃取水中的碘,使碘浓度下降,平衡逆向移动,故D错误; 故选D. |
相似问题
已知448℃时反应H2(g)+I2(g)?2HI(g)的平衡常数是49 则HI(g)?12H2(g)
已知448℃时反应H2(g)+I2(g)?2HI(g)的平衡常数是49,则HI(g)?12H2(g)+12I2(g)在该温度下的平衡常数是( )A.149B.2401C.7D.17
已知:25℃时 弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5 Ka(HClO)=
已知:25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1 8×10-5,Ka(HClO)=3 0×10-8,Ka(HF)=3 5×10-4,Ka1(H2CO3)=4 3×10-7,Ka2(H2CO3)=5 6×10-11
在两个容器中 一个盛有2 mol HCl气体 另一个盛有1 mol H2和1 mol Cl2的混合气
在两个容器中,一个盛有2 mol HCl气体,另一个盛有1 mol H2和1 mol Cl2的混合气体。在同温同压下,下列表述正确的是 [ ]A.原子数、分子数、体
一定条件下 反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行 测得2min内 N
一定条件下,反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,达到化学平衡时,则其平衡常数表达式为______.
(1)平衡常数K表示可逆反应的进行程度 K值越大 表示______(2)大小与温度的关系是:温度升高
(1)平衡常数K表示可逆反应的进行程度,K值越大,表示______(2)大小与温度的关系是:温度升高,K值______(填一定增大、一定减小、或可能增大也可能减小).












