已知:25℃时 弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5 Ka(HClO)=
| 已知:25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HClO)=3.0×10-8,Ka(HF)= 3.5×10-4,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题: (1)25℃时,将10 mL pH =1的CH3COOH溶液和10 mL pH =1的HF溶液分别与10 mL 0.1mol/L的NaHCO3溶液混合。 ①画出产生的气体体积(V)随时间(t)变化的示意图。 ②反应结束后所得的两溶液中,c(CH3COO-)_______c(F-)(填“>”、“<”或“=”)。 (2)25℃时,将少量CO2通入足量NaClO中,写出该反应的离子方程式_________,此反应的平衡常数K= ________________。 (3)0.18 mol/LCH3COONa溶液的pH为____。 |
参考解答
(1)①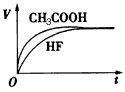 |
| ②> (2)CO2+H2O+ClO=HCO3-+ HClO;14.3 (3)9 |
相似问题
在两个容器中 一个盛有2 mol HCl气体 另一个盛有1 mol H2和1 mol Cl2的混合气
在两个容器中,一个盛有2 mol HCl气体,另一个盛有1 mol H2和1 mol Cl2的混合气体。在同温同压下,下列表述正确的是 [ ]A.原子数、分子数、体
一定条件下 反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行 测得2min内 N
一定条件下,反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,达到化学平衡时,则其平衡常数表达式为______.
(1)平衡常数K表示可逆反应的进行程度 K值越大 表示______(2)大小与温度的关系是:温度升高
(1)平衡常数K表示可逆反应的进行程度,K值越大,表示______(2)大小与温度的关系是:温度升高,K值______(填一定增大、一定减小、或可能增大也可能减小).
在一恒温恒容密闭容器中 A B气体可建立如下平衡:2A(g)+2B(g)?C(g)+3D(g)现分别
在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g)?C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ.A、B的起始量均为2mol;Ⅱ.C、D的起
下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O22CO2
下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O22CO2+4H2O。(已知甲醇的标准燃烧热为-725 76kJ·mol-1) (1)












