(10分)I 为了探究HClO的漂白性 某同学设计了如下的实验。(1)通入Cl2后 从集气瓶A中干燥
| (10分) I、为了探究HClO的漂白性,某同学设计了如下的实验。 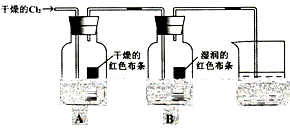 (1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 。 (2)从集气瓶B中湿润的红色布条的现象可得出的结论是______________。 (3)烧杯中发生反应的化学方程式是_________________________________。 II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于 。 (2)某次采集的硫酸工业产区酸雨样品,每隔一段时间测定一次pH值,得数据如下
|
参考解答
| (2分/空,共10分) (1)干燥的氯气没有漂白性 (2)HClO具有漂白性(或答潮湿的Cl2具有漂白性) (3) Cl2+2NaOH=NaCl+NaClO+H2O II、 (1) 显酸性的原因是 CO2+H2O 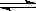 H2 CO3 H2 CO3(2) SO2+H2O 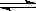 H2 SO3 , 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4) H2 SO3 , 2H2 SO3+ O2= 2H2 SO4(或回答SO2溶于雨水后,被不断氧化为H2 SO4) |
| I、(1)通入Cl2后,从集气瓶A中干燥的红色布条不褪色,可得出的结论是干燥的氯气没有漂白性 (2)从集气瓶B中湿润的红色布条褪色,可得出的结论是HClO具有漂白性(或答潮湿的Cl2具有漂白性) (3)烧杯中发生反应的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O II、(1)正常雨水显酸性,其pH约值等于5.6,这是由于二氧化碳溶于水得到碳酸的缘故。 (2)酸雨的形成主要是二氧化硫溶于水形成亚硫酸的缘故,放置酸雨一段时间,pH值变小的主要原因是亚硫酸氧化为硫酸的缘故,酸性增强,PH减弱。 |
相似问题
(18分)科学探究结果的准确性来自于探究活动中研究方法的科学性 研究过程的计划性 研究目的明确性。(
(18分)科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性。(一)学生(甲)应用下图装置(A)所示意的方法研
某班学生在老师指导下探究氮的化合物的某些性质。(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气
某班学生在老师指导下探究氮的化合物的某些性质。(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气体,并完成氨的催化氧化。A中加入浓氨水,D中加
(6分)据“网易新闻中心”报道 2008年12月13日 湖北大冶市金牛镇小泉村发生了群体中毒事件 三
(6分)据“网易新闻中心”报道,2008年12月13日,湖北大冶市金牛镇小泉村发生了群体中毒事件,三名儿童在送往医院途中死亡,另两名儿童至今日仍在医院治疗
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙 氢氧化铝
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
已知1 2-二氯乙烷常温下为无色液体 沸点为83.5 ℃ 密度为1.23 g·mL-1 难溶于水 易
已知1,2-二氯乙烷常温下为无色液体,沸点为83 5 ℃,密度为1 23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78 5 ℃。某化学课












