一氧化碳是一种用途相当广泛的化工基础原料。(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍
| 一氧化碳是一种用途相当广泛的化工基础原料。 (1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: 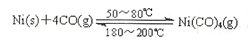  则该反应的△H 0(选填“>” 或“<”)。 (2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知: C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1 CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1 S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1 请写出CO除SO2的热化学方程式 。  (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 。(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。 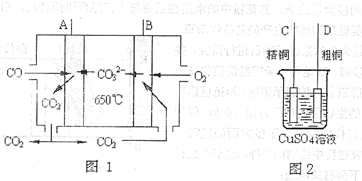 回答下列问题: ①写出A极发生的电极反应式 。 ②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。 ③当消耗标准状况下2.24LCO时,C电极的质量变化为 。 |
参考解答
(1)< (2) 2CO(g)+SO2(g)=S(s)+2CO2(g) 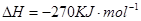 (3分) (3分)(3) 75% 0.045mol  L-1min-1 L-1min-1(4)?CO-2e-+CO 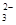 =2CO2(3分) ?D ?增加6.4g(不写“增加”也给分) =2CO2(3分) ?D ?增加6.4g(不写“增加”也给分) |
| (1)根据方程式可知,升高温度平衡向逆反应方向方向移动,所以正反应是放热反应。 (2)考查盖斯定律的应用。根据反应①C(s)+O2(g)=CO2(g)、反应②CO2(g)+C(s)=2CO(g)反应③S(s)+O2(g)=SO2(g)可知,①-②-③即得到2CO(g)+SO2(g)=S(s)+2CO2(g),所以反应热是-393.5kJ.mol-1-172.5kJ.mol-1+296.0kJ.mol-1=-270 kJ.mol-1. (3)设CO的转化率是x,则生成CO2和氢气是0.60x。所以根据平衡常数的表达式可知 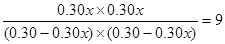 ,解得x=0.75. ,解得x=0.75.(4)①A电极通入的是CO,所以A是负极。电极反应式为CO-2e-+CO 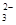 =2CO2。 =2CO2。②B是正极,则和粗铜相连,即和D相连。 ③标准状况下2.24LCO是0.1mol,转移电子是0.2mol,所以析出铜是0.1mol,即质量增加6.4g。 |
相似问题
在下图中的8个装置中 属于原电池的是( )A.①④⑤B.③⑥⑧C.④⑥⑦D.⑥⑦⑧
在下图中的8个装置中,属于原电池的是( )A.①④⑤B.③⑥⑧C.④⑥⑦D.⑥⑦⑧
下列装置能够组成原电池的是( )A.B.C.D.
下列装置能够组成原电池的是( )A.B.C.D.
下列各组的电极材料和电解液 不能组成原电池的是( )A.铜片 石墨棒 稀硫酸B.铜片 石墨棒 硝酸
下列各组的电极材料和电解液,不能组成原电池的是( )A.铜片、石墨棒,稀硫酸B.铜片、石墨棒,硝酸银溶液C.锌片、铜片,稀盐酸D.铜片、银片,FeCl3溶液
(1)下列装置能组成原电池的是______.(填序号)(2)对于锌-铜-稀硫酸组成的原电池装置 当导
(1)下列装置能组成原电池的是______.(填序号)(2)对于锌-铜-稀硫酸组成的原电池装置,当导线中有1mol电子通过时,锌片溶解了______g,铜片上析出__
下列各选项中所述的两个量 前者一定大于后者的是( )A.H3BO3的酸性与H2CO3的酸性B.向
下列各选项中所述的两个量,前者一定大于后者的是()A.H3BO3的酸性与H2CO3的酸性B.向Ag2CrO4浑浊液中加NaCl溶液,有AgCl沉淀生成,Ksp (Ag2CrO4) 与












