(7分)理论上讲 任何自发的氧化还原反应都可以设计成原电池。(1)将纯锌片和纯铜片按图示方式插入同浓
(7分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。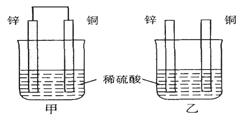 (1)将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,则甲、乙两种装置中属于原电池的是 ,甲装置中铜片上的现象是 。 (2)利用反应“ Fe + 2 Fe3+ =3 Fe2+ ”可以设计一个化学电池,若正极材料用石墨碳棒,则该电池的负极材料是 ,电解质溶液是 。 (3)据报道,最近摩托罗拉公司研制了一种由CH3OH和O2以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍。已知该电池的总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则该燃料电池的正极上的电极反应式为 ,当外电路通过1.2mole-时,理论上消耗CH3OH g。 |
参考解答
| (1)甲(1分) 铜片表面产生无色气泡(1分) (2)铁片(1分) FeCl3溶液等(1分) (3)O2 +4e- +2H2O =4OH- (2分) 6.4g (1分) |
| (1)比较甲图、乙图: 相同点:都发生了同一个反应,Zn+H2SO4=ZnSO4+H2↑ 不同点:甲构成原电池,乙中铜片无变化; 甲图:(-)锌片:Zn-2e-=Zn2+ (+)铜片:2H++2e-= H2↑ 所以铜片上的现象是:产生无色气泡; (2)分析氧化还原反应“ Fe + 2 Fe3+ =3 Fe2+ ”:单质铁由0价升高到+2价,被氧化,失电子,故为负极反应;Fe3+中铁由+3价降低到+2价,被还原,得电子,故为正极反应;所以该电池的负极材料是铁片,溶液提供Fe3+,则溶液可以是氯化铁、硫酸铁、硝酸铁等溶液; (3)分析总反应中的得失电子情况,得:是氧气中0价氧得电子变为-2价,又是用强碱作电解质溶液,则正极反应式为:O2 +4e- +2H2O =4OH-; 2CH3OH+3O2+4OH-=2CO32-+6H2O —— 12e- 64g 12mol m(CH3OH) 1.2mol 所以,m(CH3OH)=6.4g |
相似问题
右图是某学生设计的一个原电池 若要装置中电流计发生偏转 则M N两极的组成材料是 ( )A.
右图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料是()A.Zn、Zn B.Zn、CuC.Cu、Cu D.石墨、石墨
关于下图装置的叙述 错误的是A.铜是正极 其质量不变B.氢离子在铜表面被氧化 产生气泡C.电流从铜片
关于下图装置的叙述,错误的是A.铜是正极,其质量不变B.氢离子在铜表面被氧化,产生气泡C.电流从铜片经导线流向锌片D.电子从锌片经导线流向铜片
钢铁发生吸氧腐蚀时 负极上发生的电极反应是( )A.2H+ + 2e- ='==' H2↑B.Fe
钢铁发生吸氧腐蚀时,负极上发生的电极反应是()A.2H+ + 2e- = "== " H2↑B.Fe == Fe2+ + 2e-C.2H2O + O2 + 4e- = "== " 4OH-D.Fe3+ + e- = "== " Fe2+
在由铜锌组成的原电池(电解质是稀硫酸)中 有位同学在铜电极收集到了标准状况下22.4L的气体 (1
在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了标准状况下22 4L的气体, (1) (1分)铜锌原电池的总反应的离子方程式为:______
把a b c d四块金属浸泡在稀H2SO4中 用导线两两相连可组成原电池。若a b相连时 a为负极;
把a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连可组成原电池。若a、b相连时,a为负极;c、d相连时,c为负极,a、c相连时,c为正极,b、d相连时,b












