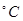硫酸工业中SO2转化为SO3是重要的反应之一 在一定压强和催化剂作用下在2L密闭容器中充入0.8mo
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)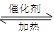 2SO3(g),SO2的转化率随温度的变化如下表所示: 2SO3(g),SO2的转化率随温度的变化如下表所示:
(2)能判断该反应是否达到平衡状态的是 A. 容器的压强不变 B. 混合气体的密度不变 C. 混合气体中SO3的浓度不变 D. C(SO2)=C(SO3) E. v正(SO2)=v正(SO3) F. v正(SO3)=2v逆(O2) (3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1. ①0~2min之间,O2的反应速率为 . ②此时的温度为 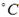 .③此温度下的平衡常数为 (可用分数表示). .③此温度下的平衡常数为 (可用分数表示).④若将平衡反应混合物的压强增大1倍(假如体积可变),此时Qc为 ,平衡将 向移动。 |
参考解答
| (共10分)(1)(1分)< (2)(2分)A C F (3)(7分)①0.08mol·L-1·min-1②600 ③ 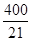 L·mol-1 L·mol-1④ 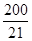 L·mol-1 正 L·mol-1 正 |
试题分析:(1)由表可知温度越高SO2的转化率越低,故总反应为放热反应,即△H<0。 (2)A.对于反应前后体积变化的反应,容器内压强不再发生变化,说明反应达到平衡状态,故A正确; B.容器中气体的密度=m/V,反应前后质量守恒,反应在体积不变的容器中进行,所以气体的密度始终不变,故B错误; C.达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,反应混合物中,SO3的质量分数不再改变,故C正确; D.浓度相等不能判读反应达到化学平衡状态,故D错; E.化学反应中转化的物质的量之比等于化学计量数之比,不能作为判断是否达到化学平衡的依据,故E错误; F. v正(SO3): v逆(O2)=2:1,表明正逆反应速率相等是平衡状态,故F正确。 (3)①? C(SO2)=(0.8mol/2L)-0.08mol·L-1=0.32mol·L-1, v(SO2)=? C(SO2)/?t=(0.32mol·L-1)/2min='0.16' mol·L-1·min-1,根据化学反应速率之比等于化学计量数之比,故v(O2)= v(SO2)/2=0.08mol·L-1·min-1。 ②由①可知? C(SO2)=0.32mol·L-1,故w(SO2)='[(0.32' mol·L-1)*100%/( 0.8mol/2L)=80.0%,对照表中数据可知温度为600 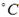 。 。③K= 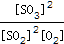 =(0.32mol·L-1)2/[(0.08mol·L-1)2*0.84 mol·L-1= =(0.32mol·L-1)2/[(0.08mol·L-1)2*0.84 mol·L-1= 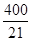 L·mol-1。 L·mol-1。点评:本题主要考查化学平衡的计算,题目难度不大,注意三段式计算方法的运用。 |
相似问题
某探究小组利用丙酮的溴代反应:( )来研究反应物浓度与反应速率的关系。反应速率通过测定溴的颜色消失所
某探究小组利用丙酮的溴代反应:( )来研究反应物浓度与反应速率的关系。反应速率通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验
下列体系加压后 对化学反应速率没有明显影响的是( ) A.2SO2+O22SO3B.I2(g
下列体系加压后,对化学反应速率没有明显影响的是( ) A.2SO2+O22SO3B.I2(g)+H22HIC.CO2+H2OH2CO3D.H++OH- H2O
下列各图是温度(或压强)对应2A(s)+2B(g)2C(g)+D(g)△H>0
下列各图是温度(或压强)对应2A(s)+2B(g)2C(g)+D(g)△H>0的正、逆反应速率的影响,其中正确的是
( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3 产生气体的体积随时间的变
( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题:
影响化学反应速率的因素很多 某课外兴趣小组用实验的方法进行探究。实验一:他们利用Cu Fe Mg和不
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0 5mol L、2mol L、18 4mol L),设计