已知: ①25℃时 弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5 Ka( HSC
| 已知: ①25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka( HSCN)= 0.13;难溶电解质的溶度积常数:Ksp(CaF2) =1.5×10-10。 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化), 得到c( HF)、c(F-)与溶液pH的变化关系,如下图所示: |
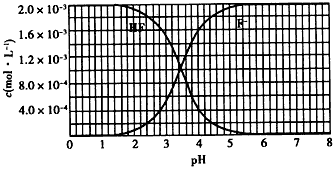 |
| 请根据以上信息回答下列问题: (1)25℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN液分别与20 mL 0.10 moI/LNaHCO3溶液混合,实验测得产生的气体体积(v)随时间(t)变化的示意图为: |
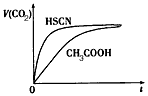 |
| 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是____ ,反应结束后所得两溶液中, c(CH3COO-)____c(SCN-)(填“>”、“<”或“=”)。 (2)25℃时,HF电离平衡常数的数值K≈____ ,列式并说明得出该平衡常数的理由______________ (3)4.0×l0-3mol/L HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节时混合液体积的变化),通过列式计算说明是否有沉淀产生。____________________ |
参考解答
| (1)HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率较快;< (2)10-3.45(或3.5×10-4);当c(F-)=c(HF)时,Ka=c(H+),查图中的交点处即为c(F-)=c(HF),故所对应的pH即为Ka的负对数 (3)查图,当pH=4.0时,溶液巾的c(F-)=1.6×10-3mol/L,溶液中c(Ca2+)=2.0×l0-4 mol/L,c( Ca2+)×c2(F-)= 5.l×10-10> Ksp( CaF2),有沉淀产生 |
相似问题
下列各表述与示意图一致的是[ ]A.图①表示25℃时 用0.1 mol·L-1盐酸滴定20
下列各表述与示意图一致的是[ ]A.图①表示25℃时,用0 1 mol·L-1盐酸滴定20 mL 0 1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 B.图②中
一定温度下 向1 L密闭容器中加入1 mol HI(g) 发生反应:2HI(g)H2(g)+I2(g
一定温度下,向1L密闭容器中加入1molHI(g),发生反应:2HI(g)H2(g)+I2(g),H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=________
在某温度下 可逆反应mA+nB?pC+qD平衡常数为K 下列说法正确的是( )A.K越大 达到平衡
在某温度下,可逆反应mA+nB?pC+qD平衡常数为K,下列说法正确的是( )A.K越大,达到平衡时,反应进行的程度越大B.K越小,达到平衡时,反应物的转化
氮是地球上含量丰富的一种元素 氮及其化合物在工农业生产 生活中有着重要作用.请回答下列问题:(1)如
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是N2和H2反应生成2molNH3过程中能量变化示意
现有反应:CO(g)+H2O(g)CO2(g)+H2(g) 其△H<0 在850℃时 Kc=1。(1
现有反应:CO(g)+H2O(g)CO2(g)+H2(g),其△H<0,在850℃时,Kc=1。(1)若升高温度到950℃时,达到平衡时Kc______1(填“大于”、“小于”或“












