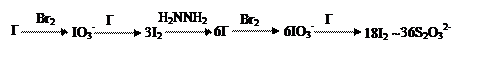对少量的碘化物可利用“化学放大”反应进行测定。其步骤如下:在中性或酸性介质中先用Br2将试样中的I-
| 对少量的碘化物可利用“化学放大”反应进行测定。其步骤如下:在中性或酸性介质中先用Br2将试样中的I-定量地氧化成碘酸盐,然后加入过量的KI,用CCl4萃取生成的I2(萃取率为100%)。分区水层后,用肼(即联氨H2N—NH2)的水溶液将I2反萃取至水层中(H2NNH2+2I2=4I-+N2+4H+),在用过量的Br2氧化,除去剩余的Br2后加入过量的KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定(反应式为I2+2S2O32-=S4O62-+2I-),求得I-的含量。 (1)上述过程中有一些化学反应的方程式在题中未给出,请写出它们的离子方程式。 (2)根据有关反应的化学计量关系说明经上述步骤后试样中1molI-可消耗Na2S2O3的物质的量是多少? (3)若在测定时,准确移取25.00mL含KI的试液,终点时耗用20.06mL0.100mol/L Na2S2O3溶液,请计算试液中KI的物质的量浓度。 |
参考解答
| (1)I-+3Br2+3H2O=IO3-+6Br-+6H+ ,IO3-+5I-+6H+=3I2+3H2O。 (2)1molI-可消耗36molNa2S2O3 (3)2.23×10-3mol·L-1 |
本题给出了有关定量分析方法的信息,涉及了一些未知的化学反应以及定量分析的步骤,解题时必须理清题中思路,把握住化学变化的脉络,找出相关物质之间的物质的量的关系,列出关系式即可。此题的信息源是定量分析中的测定微量I-的一种方法,剂“化学放大法”。由题中提供的思路可得如下关系:
很显然,1molI-最终生成18molI2(含36molI),相当于放大36倍,耗36mol S2O32-。 根据上述分析即可求解第(3)问,设KI物质的量浓度为x,则有: I- ~ 36S2O32- 1mol 36mol 0.025x 0.100×0.02006mol 求得x=2.23×10-3mol/L。 |
相似问题
有机物的天然提取和人工合成往往得到的是混合物 假设给你一种这样的有机混合物让你研究 一般要采取的几个
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是[ ]A.分离、提纯→确定分子式→确定实
学生设计了三个实验方案 用以检验淀粉的水解情况.方案甲:淀粉液H2SO4△水解液NaOH中和液碘水溶
学生设计了三个实验方案,用以检验淀粉的水解情况.方案甲:淀粉液H2SO4△水解液NaOH中和液碘水溶液变蓝结论:淀粉完全没有水解方案乙:淀粉液H2SO4△水
如图实验装置设计正确 且能达到目的是( )A.实验Ⅰ:制取纯净氢氧化亚铁B.实验Ⅱ:证明非金属性强
如图实验装置设计正确、且能达到目的是( )A.实验Ⅰ:制取纯净氢氧化亚铁B.实验Ⅱ:证明非金属性强弱:S>C>SiC.实验Ⅲ:除去CO2中的HClD.实验
下列实验装置 现象 结论不正确的是 [ ]A.AB.BC.CD.D
下列实验装置、现象、结论不正确的是[ ]A AB BC CD D
下列实验方案不能达到实验目的是( )实验目的实验方案A证明溴乙烷发生消去反应有乙烯生成向试管中加入
下列实验方案不能达到实验目的是( )实验目的实验方案A证明溴乙烷发生消去反应有乙烯生成向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产