下列叙述中正确的是A.体积相同 浓度均为0.1mol/L的NaOH溶液 氨水 分别稀释m倍 n倍 溶
下列叙述中正确的是
|
参考解答
| BD |
| A:体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,由于前者全部电离、后者部分电离,前者的pH大于后者,而在稀释过程,两者的pH均减小,但由于弱碱氨水中存在电离平衡,可补充部分OH—,导致氨水溶液的pH降低速率相对较小,故无法确定两溶液pH均为9时两者稀释的倍数大小 B:设甲、乙两醋酸溶液的电离度分别为α甲、α乙,由于前者酸性强,浓度较大,α甲相对较小;根据c(H+)=cα可知,c甲=  ,c乙= ,c乙=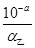 ; ;依题意可知,两溶液所含有溶质的物质的量相等,即:  V甲= V甲=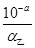 V乙,推得 V乙,推得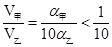 ,即V(乙)>10V(甲),正确 ,即V(乙)>10V(甲),正确C:NaOH溶液和NaAc溶液,前者OH—抑制了水的电离:H2O  H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除 H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除D:符合电荷守恒,正确 答案为BD |
相似问题
已知某温度下 0.1mol·L-1 NaHA的强电解质溶液中 c(H+) < c(OH-) 则下列关
已知某温度下,0 1mol·L-1 NaHA的强电解质溶液中,c(H+) < c(OH-),则下列关系一定正确的是A.c(Na+) = c(HA-) + 2c(A2-) + c(OH-)B.c(H+
若HA H2B为两种浓度均为0.1mol/L的酸溶液 常温下测得pH分别为:1.5和1.8。下列说法
若HA、H2B为两种浓度均为0.1mol L的酸溶液,常温下测得pH分别为:1.5和1.8。下列说法中正确的是 A.HA和H2B都是弱酸,且H2B酸性强于HA B.当NaA,Na
(8分)常温下 将某一元酸HA和NaOH溶液等体积混合 两种溶液的浓度和混合后所得溶液的pH如下表:
(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:实验编号HA物质的量浓度(mol·L-1)NaOH物质的量浓度(mol
欲使0.1 mol·L-1的NaHCO3溶液中c(H+) c(CO32-) c(HCO3-)都减小
欲使0 1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )A.通入CO2B.加入NaOH固体C.通入HClD.加入饱和石灰水溶液
(12分)孔雀石主要含Cu2(OH)2CO3 还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备C
(12分)孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。且知:溶液A只含Cu2+、Fe2+












