(9分)人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活 生产和科学技术发展中 电池发挥
| (9分)人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学 技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题: (1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。 ①工作时电子从________极流向________极(填“Ag2O”或“Zn”)。其用到的电解质溶液是 (填“KOH ”或"H2SO4") ②电极反应式:正极____________________________________________, ③工作时电池电解质溶液pH________(填“增大”、“减小”或“不变”)。 (2) 2009年10月,中国科学院长春应用化学研究所在甲醇(CH3OH一种可燃物)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如右图所示。 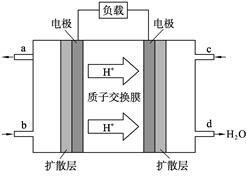 ①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。 ②该电池正极的电极反应式___________ ③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。 |
参考解答
| (1)①Zn ; Ag2O; KOH ②Ag2O+H2O+2e-=2Ag+2OH- ③增大 (2)①CH3OH; O2 ②O2+4H++4e-=2H2O ③1.2 |
| 考查原电池的有关判断及计算。 (1)在原电池中负极失去电子,经导线传递到正极上。根据反应式可知锌上负极,氧化银上正极,所以电子从锌极流向氧化银极。由于锌上活泼的金属,所以电解质溶液不能酸性溶液,而是碱性溶液,即为氢氧化钾。氧化银上正极,正极得到电子,电极反应式为Ag2O+H2O+2e-=2Ag+2OH-。根据总反应式可知,反应后生成了氢氧化锌,所以溶液的碱性是增强的,即陪÷ H是增大的。 (2)在原电池中负极失去电子,经导线传递到正极上,所以溶液中的阳离子向正极移动。根据装置图可知氢离子向右侧移动,所以右侧电极是正极,左侧是负极。在燃料电池中负极是通入可燃物的,即甲醇在左侧通入,所以b处通入的是甲醇,c处通入的是氧气。由于氢离子向正极移动,所以正极电极反应式为O2+4H++4e-=2H2O。甲醇的氧化产物是CO2,碳的化合价升高4-(-2—)=6个单位,所以6.4g甲醇完全反应失去的电子是 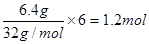 。 。 |
相似问题
下图为原电池的示意图。请回答:(1)Zn极为原电池的 (填“正”或“负”)极 该极的电
下图为原电池的示意图。请回答:(1)Zn极为原电池的(填“正”或“负”)极,该极的电极反应式是,属于(填“氧化反应”或“还原反应”)。(2)(填“
下图各装置中(电解质溶液均为硫酸) 不能构成原电池的是
下图各装置中(电解质溶液均为硫酸),不能构成原电池的是
(5分)某种电池的电极材料为Al和Mg 电解质溶液为KOH (1) 电池的负极的电极反应式为____
(5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,(1) 电池的负极的电极反应式为__________正极发生的是_______________反应(填反应类型);(2) 总反
由铝 铁 铜 银和稀硫酸 可以组成原电池的总数为A.3种B.4种C.5种D.6种
由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为A.3种B.4种C.5种D.6种
(8分)如图所示的原电池中 回答下列问题(1)负极材料 (2)写出电极反应
(8分)如图所示的原电池中,回答下列问题(1)负极材料(2)写出电极反应式:正极:;负极:。(3)写出电极反应总反应式(4)电子由极流向极(填写Zn或Cu)












