(8分)如图所示的原电池中 回答下列问题(1)负极材料 (2)写出电极反应
| (8分)如图所示的原电池中,回答下列问题 (1)负极材料 (2)写出电极反应式:正极: ;负极: 。 (3)写出电极反应总反应式 (4)电子由 极流向 极(填写Zn或Cu) 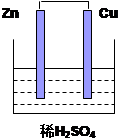 |
参考解答
| (1)Zn (2分) (2)2H++2e-=H2 (1分) Zn-2e-=Zn2+ (1分) Zn+2H+=Zn2++H2 (2分) (4)Zn Cu (2分) |
| 考查原电池的有关判断和应用。在原电池中较活泼的金属作负极,失去电子,发生氧化反应,所失去的电子经导线传递到正极上。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,发生还原反应生成氢气。 |
相似问题
(6分)在由Cu片 Zn片和200 mL稀H2SO4组成的原电池中 当Cu片上放出2.24 L(标准
(6分)在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2 24 L(标准状况下)H2时,H2SO4恰好用完。问:(1)此时在导线上有多少摩尔电子
关于下图所示装置的说法中 不正确的是A.锌片是该装置的负极 该电极反应为Zn—2e—=Zn2+B.电
关于下图所示装置的说法中,不正确的是A.锌片是该装置的负极,该电极反应为Zn—2e—=Zn2+B.电子由锌片通过导线流向铜片C.该装置能将化学能转化为电能
在理论上不能用于设计原电池的化学反应是( )A.H2SO4+BaCl2==2HCl+BaSO4↓B.
在理论上不能用于设计原电池的化学反应是()A.H2SO4+BaCl2==2HCl+BaSO4↓B.2CH3CH2OH+3O22CO2+4H2OC.4Fe(OH)2+2H2O+O2==4Fe(OH)3D.3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
干电池的总反应方程式为Zn+2NH4+==Zn2++2NH3+H2。下列说法中正确的是A.锌作正极
干电池的总反应方程式为Zn+2NH4+==Zn2++2NH3+H2。下列说法中正确的是A.锌作正极,发生氧化反应B.锌作负极,发生氧化反应C.锌作正极,发生还原反应D.
下面能够构成原电池及电极反应式正确的是A.Fe Cu 浓硝酸溶液 负极反应式为:Fe-2e-==Fe
下面能够构成原电池及电极反应式正确的是A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-==Fe2+B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-==Cu2+C.Al、Mg












