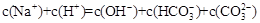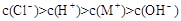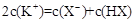下列溶液中离子浓度的关系一定正确的是A.和溶液中:B.一元弱碱MOH对应的盐MCl溶液中:C.等物质
下列溶液中离子浓度的关系一定正确的是
 |
参考解答
| C |
试题分析:A、由电荷守恒式知,Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—) ,错误;B、一元弱碱MOH对应的盐MCl溶液中:c(Cl-)> c(M+) >c(H+)> c(OH-) ,错误;C、根据物料守恒知,等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)= c(X-)+ c(HX),正确;D、当酸为强酸,碱为强碱时,pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:c(M+)= c(X—) >c(H+)= c(OH-),当酸为弱酸或碱为弱碱时,该等式不成立,错误。 |
相似问题
室温下向10mL pH=3的醋酸溶液中加入水稀释后 下列说法错误的是( )A.溶液中导电粒子的数目
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法错误的是()A.溶液中导电粒子的数目增加B.溶液中不变C.醋酸的电离程度增大,但电离平衡常数Ka
部分弱酸的电离平衡常数如下表:弱酸HCOOHHCNH2CO3电离平衡常数(25℃)Ka=1.77×1
部分弱酸的电离平衡常数如下表:弱酸HCOOHHCNH2CO3电离平衡常数(25℃)Ka=1 77×10-4Ka=4 9×10-10Ka1=4 3×10-7Ka2=5 6×10-11下列选项正确的是A 2CN
某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- HA-H+ + A2- (
某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- HA-H+ + A2- (Ka=1 0×10-2),下列说法正确的是A.在0 1 mol·L-1的H2A溶液中,c(H+
室温下 对于醋酸及其盐的下列判断正确的是A.稀醋酸溶解石灰石的离子方程式为CaCO3+2H+=Ca2
室温下,对于醋酸及其盐的下列判断正确的是A.稀醋酸溶解石灰石的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑B.稀醋酸加水稀释后,溶液中c(CH3COO-) c(
下列叙述中 不正确的是A.pH=2与pH=1的CH3COOH溶液中 c(H+)之比为1 :10B.1
下列叙述中,不正确的是A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10B.1 0mol L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)C.仅含Na


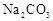 和
和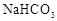 溶液中:
溶液中: