一定条件下 在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.
| 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态. (1)该反应的平衡常数表达式K=______,根据上图降低温度K将______(填“增大”、“减小”或“不变”. (2)500℃时,从反应开始到达到平衡状态,以CO的浓度变化表示的化学反应速率是v(CO)=______(用nB,tB表示). (3)判断可逆反应达到平衡状态的标志是______(填字母). a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变 c.容器内气体的压强保持不变 d.CO、H2、CH3OH的浓度不再改变 (4)300℃时,将容器的体积增大1倍,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母). a.c(H2)增大 b.正反应速率减慢,逆反应速率加快 c.CH3OH的物质的量减小 d.重新平衡时c(H2)/c(CH3OH)增大. 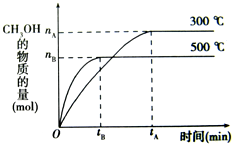 |
参考解答
(1)CO(g)+2H2(g)?CH3OH(g)化学平衡常数k=
根据图象可知,温度越低,甲醇的含量越高,说明降低温度平衡向正反应移动,平衡常数增大, 故答案为:
(2)v(CH3OH)=
故答案为:
(3)a.v生成(CH3OH)=v消耗(CO),都表示正反应速率,始终按此比例进行,不能说明反应到达平衡,故a错误; b.混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,混合气体的密度不再改变,不能说明到达平衡,故b错误; c.随反应进行,容器内混合气体的总的物质的量减小,压强降低,容器内气体的压强保持不变,说明到达平衡,故c正确; d.平衡时各组分的浓度不变,CO、H2、CH3OH的浓度不再改变,说明到达平衡,故d正确; 故答案为:cd; (4)a.300℃时,将容器的体积增大1倍,压强减小,平衡向逆反应方向移动,但平衡移动不能消除浓度减小,故c(H2)减小,故a错误; b.300℃时,将容器的体积增大1倍,压强减小,正、逆反应速率都减小,正反应速率减小更多,平衡向逆反应方向移动,故b错误; c.300℃时,将容器的体积增大1倍,压强减小,平衡向逆反应方向移动,CH3OH的物质的量减小,故c正确; d.300℃时,将容器的体积增大1倍,压强减小,平衡向逆反应方向移动,氢气物质的量增大,甲醇的物质的量减小,故重新平衡时c(H2)/c(CH3OH)增大,故d正确; 故答案为:cd. |
相似问题
在铝与稀硫酸的反应中 已知10s末硫酸的浓度减少了0.6mol/L 若不考虑反应过程中溶液体积的变化
在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0 6mol L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )A.0 02mol
一定条件下 发生如下反应:A(g)+2B(g)?xC(g)+D(g)△H<0 x为正整数).(1)4
一定条件下,发生如下反应:A(g)+2B(g)?xC(g)+D(g)△H<0,x为正整数).(1)450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4mol
可逆反应2A(g)+2B(g)?C(g)+3D(g) 在不同情况下测得下列四种反应速率 其中反应最快
可逆反应2A(g)+2B(g)?C(g)+3D(g),在不同情况下测得下列四种反应速率,其中反应最快的是( )A.υ(C)=0 25mol (L?s)B.υ(B)=0 4mol
(15分)氮气和氢气合成氨是化学工业中极为重要的反应 其热化学方程式可表示为:N2(g)+3H2(g
(15分)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)2NH3(g)ΔH=-92kJ·mol-1请回答下列问题:(1)取1 mol
反应速率υ和反应物浓度c的关系是用实验方法测定的.化学反应H2+Cl2═2HCl的反应速率υ可表示为
反应速率υ和反应物浓度c的关系是用实验方法测定的.化学反应H2+Cl2═2HCl的反应速率υ可表示为υ=k[c(H2)]m?[c(Cl2)]n,式中k为常数,m、n值可用下












