高氯酸 硫酸 硝酸和盐酸都是强酸 其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常
| 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数 |
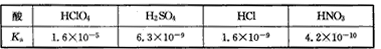 |
| 从以上表格中判断下列说法正确的是 |
| [ ] |
| A.在冰醋酸和水中这四种酸都没有完全电离 B.在冰醋酸中高氯酸是这四种酸中最弱的酸 C.在冰醋酸中硫酸的电离方程式为H2SO4==2H++SO42- D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱 |
参考解答
| D |
相似问题
分别在[H+]=1×10-1摩/升的酸溶液和[OH-]=1摩/升NaOH溶液中加入足量的铝 放出H2
分别在[H+]=1×10-1摩/升的酸溶液和[OH-]=1摩/升NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是A.两种溶液的体积相同,酸是多元强酸B.两种
下列物质中属于弱电解质的是A.KOHB.H2SO4C.CH3COOHD.NaCl
下列物质中属于弱电解质的是A.KOHB.H2SO4C.CH3COOHD.NaCl
同温度下 pH相同的盐酸和醋酸 稀释相同倍数后 分别与锌反应 若放出的氢气质量相同 则下列判断正确的
同温度下,pH相同的盐酸和醋酸,稀释相同倍数后,分别与锌反应,若放出的氢气质量相同,则下列判断正确的是 [ ]A.起始反应速率相同 B.反应所需时间
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时 都会引起[
向0.1mol L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起[ ]A.溶液的pH增大B.CH3COOH的电离程度增大 C.溶液的导电能力减小 D.溶液的c(OH-)减小
将0.1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时 都会引起 [
将0 1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起 [ ]A.溶液的pH增加 B.CH3COOH电离度变大C.溶液的导电能力减弱D.溶液中[OH-]减小












