两体积相同的密闭容器中均充入1mol X和1mol Y 分别于300℃和500℃开始发生反应:X(g
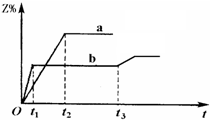
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
 |
参考解答
| A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误; B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误; C、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误; D、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确; 故选D. |
相似问题
已知某可逆反应:mA(g)+nB(g) xC(g)△H=Q kJ/mol 在密闭容器中进行如图表
已知某可逆反应:mA(g)+nB(g)xC(g)△H=QkJ mol,在密闭容器中进行如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲
下图是778 K时氮气与氢气合成氨反应过程中能量变化的曲线图 下 列叙述正确的是 [ ]A
下图是778 K时氮气与氢气合成氨反应过程中能量变化的曲线图,下 列叙述正确的是 [ ]A.此反应为吸热反应B.b曲线是加入催化剂时的能量变化曲线 C.
下列说法正确的是[ ]A.用电子式表示氯化氢分子的形成过程:B.一定条件下从正反应开始的某可
下列说法正确的是[ ]A 用电子式表示氯化氢分子的形成过程:B 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小C 酸与碱发生中和
煤化工生产中常需研究不同温度下平衡常数 投料比及产率等问题.已知:CO(g)+H2O(g)?H2(g
煤化工生产中常需研究不同温度下平衡常数、投料比及产率等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:温度 ℃400500830
一定温度下可逆反应A(s) + 2B(g) 2C(g) + D(g) △H<0。现将1 mol A和
一定温度下可逆反应A(s)+2B(g)2C(g)+D(g)△H<0。现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1












