(7分)在容积为10L的密闭容器中通入一定量的SO2和O2 450℃时发生反应:2SO2(g)+O2
(7分)在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题: 2SO3(g)(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示。请回答下列问题: (1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1 (1)0~4 min的平均反应速率v(SO2)= mol·l-1·min-1(2)在图中画出SO3的物质的量浓度随时间的变化曲线。 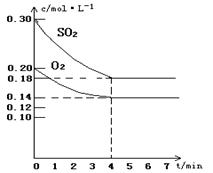 (3)在其他条件不变,7min时分别改变下列条件,将改变条件的瞬间正、逆反应速率的变化情况(“增大”、“减小”或“不变”)填入下表空格内:
|
参考解答
| (1)0.03mol/(L.min) (2) 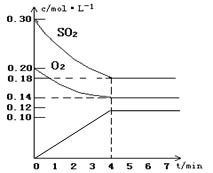 (3)
|
(1)反应速率通常用单位时间内浓度的变化量来表示,所以用SO2表示的反应速率为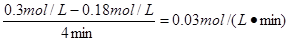 。 。(2)SO3是生成物,起始浓度为0。由于平衡时SO2的浓度的变化量是0.12mol/L,所以生成的SO3的浓度就是0.12mol/L,因此图像为 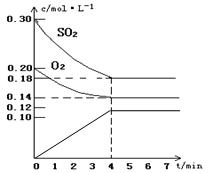 (3)考查外界条件对反应速率的影响。在其它条件不变的情况下,增大反应物浓度或升高温度或增大压强或使用催化剂都能增大反应速率。增大氧气浓度的瞬间,生成物的浓度是不变的,所以逆反应速率瞬间是不变的。减小SO3的浓度的瞬间,反应物的浓度是不变的,所以正反应速率瞬间是不变的。缩小容器的体积,压强增大,因此正逆反应速率均增大。催化剂能同等程度改变正逆反应速率,所以都增大。压强不变,充入氦气,容器容积必然增大,所以物质的浓度一定减小,因此正逆反应速率均减小。 |
相似问题
用纯净的锌粒与稀盐酸反应制取氢气气体 请回答:(1)实验过程如下图所示 分析判断________段化
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。(2)将锌粒
某课外活动小组做了一个有趣的实验:将2g铝粉和3g碘粉小心混合均匀 分为质量相等的3份 分别进行如下
某课外活动小组做了一个有趣的实验:将2g铝粉和3g碘粉小心混合均匀,分为质量相等的3份,分别进行如下实验,实验记录如下,根据表中实验事实作出推断,错误
如图是关于N2+3H22NH3 ΔH
如图是关于N2+3H22NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是A.升高温度,同时增大压强B.降低温度,同时减小压强C.增大反应物的浓
反应C (s) + H2O (g) CO(g) + H2 (g)在一可变容积的密闭容器中进行 下列条
反应C (s) + H2O (g) CO(g) + H2 (g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()A.增加C的物质的量B.将容器
氨气能发生氧化反应:4NH3+5O2=4NO+6H2O 改变下列条件使反应速率加大 其中是由于增大了
氨气能发生氧化反应:4NH3+5O2=4NO+6H2O,改变下列条件使反应速率加大,其中是由于增大了“活化分子”的百分数的是A.增加NH3浓度B.升高温度C.缩小体积












