(1)今有2H2+O22H2O反应 构成燃料电池 则负极通的应是____________ 正极通的应
(1)今有2H2+O2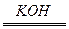 2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。 2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为____________、____________,(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化? (3)如把H2改为甲烷,KOH作导电物质,则电极反应式为____________。 |
参考解答
| (1)H2O2 负极:2H2+4OH--4e-====4H2O 正极:O2+2H2O+4e-====4OH- (2)负极:2H2-4e-====4H+ 正极:O2+4H++4e-====2H2O (1)中pH变小,(2)中pH变大。 (3)负极:CH4+10OH--8e-  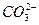 +7H2O +7H2O正极:2O2+4H2O+8e-====8OH- |
解决此题的关键是弄清原电池的有关概念,根据电池反应式可知H2在反应中被氧化,O2被还原;H2应在负极上反应,O2应在正极上反应。又因为是碱性溶液不可能有H+参加或生成,故负极反应为:2H2+4OH--4e-====4H2O,正极反应为:O2+2H2O+4e-====4OH-。若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加反应,也不可能有OH-生成,负极:2H2-4e-====4H+,正极:O2+4H++4e-====2H2O。由于前者在碱性条件反应,KOH量不变,但工作时H2O增多,故溶液变稀,pH将变小;而后者为酸溶液,H2SO4不变,水增多,溶液酸性变小,故pH将变大。如把H2改为甲烷用KOH作导电物质,则负极:CH4+10OH--8e- 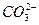 +7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。 +7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。 |
相似问题
剪长约6cm 宽2cm的铜片 铝片各一片 分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将铜片
剪长约6cm、宽2cm的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指
(3分)用导线将锌片 铜片连接后浸入稀硫酸溶液中 构成了原电池 此电池的负极是 正极的电极
(3分)用导线将锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,此电池的负极是,正极的电极反应式是。
铅蓄电池是一种典型的可充电电池 电池总反应式为Pb+PbO2+4H++22PbSO4+2H2O 则下
铅蓄电池是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++22PbSO4+2H2O,则下列说法正确的是( ) A.放电时,电流方向由B过M到AB.充电时,铅蓄电池
(14分)目前燃料电池中能量转化效率最高的是陶瓷电池 此类电池正面涂有黑色的稀有金属复合氧化物 作为
(14分)目前燃料电池中能量转化效率最高的是陶瓷电池,此类电池正面涂有黑色的稀有金属复合氧化物,作为正极,反面是一层较厚的绿色“金属陶瓷”,作为
王亮在超市看到一种电池外壳的纸层包装印有右图的文字 请根据要求回答问题.(1)该电池的种类是____
王亮在超市看到一种电池外壳的纸层包装印有右图的文字,请根据要求回答问题.(1)该电池的种类是______(填序号).①干电池②蓄电池③燃料电池(2)该












