下图是甲 乙 丙三名同学设计的验证铜和浓硝酸反应原理的装置已知:2NO2+2NaOH═NaNO3+N
| 下图是甲、乙、丙三名同学设计的验证铜和浓硝酸反应原理的装置 已知:2NO2+2NaOH═NaNO3+NaNO2+H2O 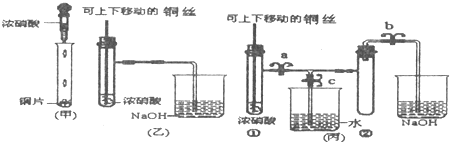 (1)写出铜和浓硝酸反应的离子反应方程式是______. (2)和甲同学装置相比,乙同学设计的装置的优点是______、______. (3)为了进一步验证NO2和水的反应,某学生设计了丙装置. 先关闭弹簧夹______(填a或b或c),再打开弹簧夹______和______(填a或b或c),才能使NO2气体充满②试管. (4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管.应如何操作______. (5)某位同学的实验中未得到蓝色的溶液,而呈绿色,他分析可能是生成的部分NO2溶解在溶液中造成的.请你帮他设计简单实验方案验证他的推测. |
参考解答
| (1)因铜和浓硝酸反应生成硝酸铜、二氧化氮和水,故答案为:Cu+4H++2NO3_=Cu2++2NO2↑+2H2O; (2)甲装置不能使反应可控制;不能吸收NO2气体,污染环境, 故答案为:①不能使反应可控制②不能吸收NO2气体,污染环境 (3)为了NO2气体充满②试管,应先关闭c,然后打开a、b,故答案:关闭c;a、b; (4)为了让二氧化氮与水接触发生反,应先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②, 故答案为:先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②; (5)铜和稀硝酸反应生成一氧化氮和硝酸铜溶液呈蓝色,铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,溶解于溶液中溶液可能成绿色; 故答案为:用Cu和稀HNO3反应,若所得溶液呈蓝色,则证明Cu和浓HNO3反应呈绿色的原因是NO2溶解在溶液中造成的; |
相似问题
甲 乙 丙 丁各是BaCl2 Na2CO3 AgNO3 HCl四种无色溶液中的一种 它们两两反应后的
甲、乙、丙、丁各是BaCl2、Na2CO3、AgNO3、HCl四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;
现有①NaOH ②Al2(SO4)3 ③Ba(NO3)2④CuSO4⑤FeCl3 ⑥淀粉溶液 ⑦KI
现有①NaOH②Al2(SO4)3③Ba(NO3)2④CuSO4⑤FeCl3⑥淀粉溶液⑦KI 这7种溶液( )A.不需外加试剂即可鉴别B.必须外加试剂才能鉴别C.如有碘水即能
(1)现有废铜屑和废硫酸 请从原料的利用率和环保的角度分析 设计一个制取胆矾(CuSO4?5H2O)
(1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明第一步:______第二步:__
用过量的H2SO4 NaOH NH3?H2O NaCl等溶液 按图所示步骤分开五种离子 则溶液① ②
用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )A.①NaCl②NaOH③NH3?H2O④H2SO4B.①H2SO4②Na
按要求填写下列实验报告:实验内容主要实验操作主要结论①除去FeSO4溶液中的少量Fe2(SO4)3
按要求填写下列实验报告:实验内容主要实验操作主要结论①除去FeSO4溶液中的少量Fe2(SO4)3,______,过滤离子方程式为:②证明SO2既有漂白性又有还原性












