(10分)为了研究碳酸钙与盐酸反应的反应速率 某同学通过下图实验装置测定反应中生成的CO2气体体积
(10分)为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。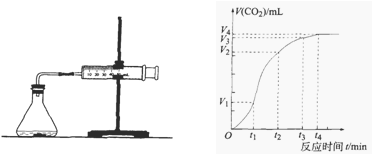 (1)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是 ,可能的原因是 ;收集到的气体最多的是 时间段。 (2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 ;
|
参考解答
| (1)t1 ~ t2 该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快t1 ~ t2 (2)AC (3)反应物中有一种已经消耗完(凡是符合题意的都给分) |
| 考查外界条件对反应速率的影响。 (1)反应速率越大,在图像中曲线的斜率就越大,所以反应最快的是t1 ~ t2。随反应的进行,反应物的浓度是减小的,但速率是增大的,这说明反应一定是放热反应,温度升高导致反应速率增大。根据纵坐标可知生成气体最多的是t1 ~ t2。 (2)要降低反应速率,就要减小反应物盐酸的浓度。A和C均是稀释盐酸,使其浓度降低。B不影响,D是增大浓度,反应速率加快。 (3)当反应进行到一定程度时,反应物被完全消耗,所以生成物的CO2的体积就不再变化。 |
相似问题
已知:4NH(g)+5O(g)4NO(g)+6HO(g) 若反应速率分别用v(NH) v(O) v(
已知:4NH(g)+5O(g)4NO(g)+6HO(g),若反应速率分别用v(NH)、v(O)、v(NO)、V(HO)[mol (L·min)]表示,则下列关系正确的是A.4v(NH)=5
(8分)在25℃时 向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前
(8分)在25℃时,向100 mL含氯化氢14 6 g的盐酸溶液里放入5 6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1 12 L(标
甲 乙两个容器内都在进行A→B的反应 甲中每分钟减少4 mol A 乙中每分钟减少2 mol A 则
甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则两容器中的反应速率A.甲快B.乙快C.相等D.无法确定
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)2C(气),若经 2 s(秒)后测得 C
在一定条件下 密闭容器中进行的反应:H2 + I2 2HI对于下列示意图所表示的涵义解释正确的
在一定条件下,密闭容器中进行的反应:H2 + I22HI对于下列示意图所表示的涵义解释正确的是()A.反应开始时,容器中投入了H2、I2、HI三种气体B.0到t1












