当温度高于40℃时 铜的平均溶解速率随着反应温度升高而下降 其主要原因是
 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。 当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。 28.(9分)下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择 A. M>N B. M<N C. M="N" D. 无法比较 ⑴相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数和2 L 0.5mol·L-1NH4Cl溶液中NH4+的个数: ; ⑵相同温度下,pH值为12的烧碱溶液中水的电离度和pH值为12的CH3COONa溶液中水的电离度: ; ⑶两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量CaO,恢复至室温,两溶液中的c(Ca2+): ; ⑷常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ; ⑸将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ; ⑹常温下0.1mol/L的CH3COOH与0.1mol/LCH3COONa等体积混合后溶液中c(Na+)和c(CH3COO-): ; ⑺同  温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ; 温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01mol·L-1FeCl3溶液中Fe3+的水解百分率: ;⑻室温下某强酸和某强碱溶液等体积混合后,溶液的pH值为7,  原酸溶液和原碱溶液的物质的量浓度: ; 原酸溶液和原碱溶液的物质的量浓度: ;⑼PH值相同的醋酸和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是: 。 |
参考解答
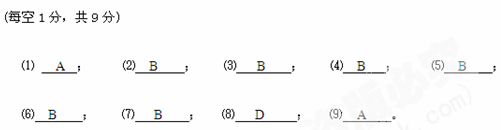 |
| 略 |
相似问题
在反应A(g) + 2B(g) = 2C(g)中 1s内A的物质的量浓度减少0.1mol/L 则用C
在反应A(g) + 2B(g) = 2C(g)中,1s内A的物质的量浓度减少0 1mol L,则用C表示的化学反应速率为()A.0 1mol (L S)B.0 2mol (L S)C.0 01mol (L S)D.0 02mol (L S)
可逆反应A(g) +3B(g)2C(g)+2D(g) 在四种不同条件下的反应速率如下 其中反应速率最
可逆反应A(g) +3B(g)2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是A.VA=0·15mol/(L·min)B.VB=0·6mol/(L·min)C.VC=0
(18分)反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件 在
(18分)反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:回答问
硫代硫酸钠溶液与稀硫酸反应的化学方程为: 下列各组实验中最先出现浑浊是( )
硫代硫酸钠溶液与稀硫酸反应的化学方程为:,下列各组实验中最先出现浑浊是()
在2A+B3C+4D的反应中 下列用不同物质的变化表示该反应的速率最快的是A.vA=0.5mol·L
在2A+B3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是A.vA=0 5mol·L-1·min-1B.vB=0 3mol·L-1·min-1C.vC=0 8mol·L-1·min-1D.vD=1mol·L-1·min-1












