40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合 混合后测得溶液
| 40mL 2mol/L的NaOH 溶液和40mL 2mol/L 的盐酸在19℃时混合,混合后测得溶液的温度为32.6℃。求反应的中和热[混合后溶液的比热容c =" " 4.18 J/(g·℃)]。 |
参考解答
| 反应的中和热为56.85 kJ/ mol 。 |
| 酸碱中和反应是放热反应,反应放出的热量可通过反应前后体系温度的变化来计算:Q = -cm(T2-T1)。中和热是在稀溶液中,1mol的H+和1mol OH-发生中和反应生成1molH2O的水时所放出的热量。稀溶液的密度接近于溶剂水的。 ⑴此稀溶液反应放出的热量为::Q = cm(T2-T1)=' 4.18' J/(g·℃)×(40mL+40mL)×1g/mL×(32.6℃-19℃)=' 4547.84' J 。 ⑵求反应的中和热: 依据 HCl + NaOH = NaCl + H2O 混合前 0.08 mol 0.08 mol 0 mol 0 mol 混合后 0 mol 0 mol 0.08 mol 0.08 mol 又依据生成0.08 mol水放出热量 4547.84 J ,生成1 mol水放出热量为: 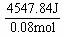 = 56.85 kJ/ mol = 56.85 kJ/ mol |
相似问题
下列物质中 既含有离子键 又含有非极性键的是( )A.NaOHB.Na2O2C.MgCl2D.H2
下列物质中,既含有离子键,又含有非极性键的是( )A.NaOHB.Na2O2C.MgCl2D.H2O2
下列反应过程中 ΔH>0且ΔS>0的是A.NH3(g)+HCl(g)NH4Cl(s)B.CaCO3(
下列反应过程中,ΔH>0且ΔS>0的是A.NH3(g)+HCl(g)NH4Cl(s)B.CaCO3(s)CaO(s)+CO2(g)C.4Al(s)+3O2(g)2Al2O3(s)D.HCl(aq)+NaOH(aq)NaCl(aq)+H2O(l)
请回答氯碱的如下问题:(1)氯气 烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=
请回答氯碱的如下问题:(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);(2)原料粗盐
下列物质中 既含有离子键又含有共价键的是( )A.CO2B.Na2OC.CaCl2D.NH4Cl
下列物质中,既含有离子键又含有共价键的是( )A.CO2B.Na2OC.CaCl2D.NH4Cl
已知2H2(g)+O2(g)2H2O(l) △H=-571.6kJ·mol-1C3H8(g)+5O
已知2H2(g)+O2(g)2H2O(l) △H=-571 6kJ·mol-1C3H8(g)+5O2(g)3CO2(g)+4H2O △H=-2 220 kJ·mol-1设有氢气和丙烷的混合气体5mol,完全燃烧时












