(8分)已知化学反应中的能量变化 是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化: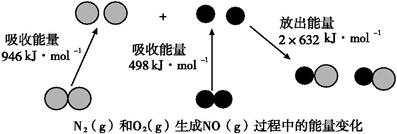 (1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式: 。 (2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为: 。 当有16 g O2(g)生成时,该反应中放出的热量为: kJ。 |
参考解答
| (1)946(2分); N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1(2分) (2)2NO(g)=N2(g)+O2(g) ΔH=-180 kJ·mol-1(2分); 90(2分) |
| (1)根据示意图可知,N≡N键的键能为946kJ/mol。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此根据键能可知,该反应的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,所以该反应的热化学方程式是N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1。 (2)正反应是吸热反应,则逆反应是放热反应,所以NO(g)分解生成N2(g)和O2(g)的热化学方程式为2NO(g)=N2(g)+O2(g) ΔH=-180 kJ·mol-1。16g氧气是0.5mol,所以放出的热量是180 kJ·mol-1×0.5mol=90kJ。 |
相似问题
下列各数值表示有关元素的原子序数 其所表示的各原子组中能相互结合成AB2型稳定共价化合物的是 A.
下列各数值表示有关元素的原子序数,其所表示的各原子组中能相互结合成AB2型稳定共价化合物的是A.18和12B.7和8C.11和16D.12和9
(10分)有下列分子或离子:(1)BF3 (2)H2O (3) NH4+ (4)SO2
(10分)有下列分子或离子:(1)BF3(2)H2O(3) NH4+(4)SO2 (5)HCHO(6)PCl3(7)CO2粒子构型为直线型的为:粒子的立体构型为V型的为:粒子的
能够用键能解释的是 A.氮气的化学性质比氧气稳定 B.常温常压下 溴呈液体 碘为固体 C.稀有气体
能够用键能解释的是 A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘为固体 C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发
下列化合物中既含有离子键又含有共价键的是 ( )A.HNO3B.CaCl2C.NH4ClD.H2S
下列化合物中既含有离子键又含有共价键的是()A.HNO3B.CaCl2C.NH4ClD.H2SO4
由短周期元素构成的离子化合物中 一个阳离子和一个阴离子的核外电子数之和为20 下列说法中正确的是A.
由短周期元素构成的离子化合物中,一个阳离子和一个阴离子的核外电子数之和为20,下列说法中正确的是A.晶体中阳离子半径一定大于阴离子半径B.晶体中一












