如图甲 乙是电化学实验装置。(1)若甲 乙两烧杯中均盛有NaCl溶液.①甲中石墨棒上的电极反应式为_
如图甲、乙是电化学实验装置。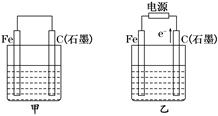 (1)若甲、乙两烧杯中均盛有NaCl溶液. ①甲中石墨棒上的电极反应式为____________________________________________。 ②乙中总反应的离子方程式为______________________________________________。 ③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________________________________________________________。 (2)若甲、乙两烧杯中均盛有CuSO4溶液. ①甲中铁棒上的电极反应式为____________________________________________。 ②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________ g。 |
参考解答
| (1)①2H2O+O2+4e-===4OH- ②2Cl-+2H2O  H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH-③5Cl2+I2+6H2O === 10HCl+2HIO3 (2)①Fe-2e- === Fe2+ ②CuO(或CuCO3) 0.8(或1.24) |
试题分析:(1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e- === 4OH-.②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2O  Cl2↑+H2↑+2OH-.③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3.(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e- === Fe2+.②乙装置为电解池,电解反应为:2CuSO4+2H2O Cl2↑+H2↑+2OH-.③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3.(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e- === Fe2+.②乙装置为电解池,电解反应为:2CuSO4+2H2O  2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态.由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=0.1×0.2=0.02(mol), 2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态.由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),故m(CuO)=0.02× 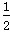 ×80=0.8(g),m(CuCO3)=0.02× ×80=0.8(g),m(CuCO3)=0.02×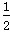 ×124=1.24(g). ×124=1.24(g).点评:本题考查原电池的设计及原电池的工作原理,题目难度中,注意从氧化还原反应的角度确定原电池的电极材料及电解质溶液。 |
相似问题
我国首创的海洋电池以铝板为负极 铂网为正极 海水为电解质溶液 空气中的氧气与铝反应产生电流。电池总反
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为:4Al + 3O2 +6H2O ===4Al(OH)3下列
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材
(1)图1装置发生反应的离子方程式为 。 (2
(1)图1装置发生反应的离子方程式为。(2)图2装置中甲烧杯盛放100 mL 0 2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0 5 mol·L-1L的CuSO4溶液。
锂电池是一代新型高能电池 它以质量轻 能量高而受到了普遍重视 目前已研制成功多种锂电池。某种锂电池的
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式是Li+MnO2 = LiMnO2。下列说法正
(10分)21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流 新研制的某汽油燃料电池的一个电极通
(10分)21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,用NaOH溶液作电












