如图所示装置(1)若烧杯中为稀H2SO4 两极反应式为:正极______负极______总反应方程式
| 如图所示装置 (1)若烧杯中为稀H2SO4,两极反应式为: 正极______ 负极______ 总反应方程式______ (2)若烧杯中为NaOH溶液,总反应方程式为:______. 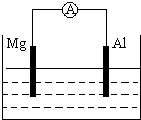 |
参考解答
| (1)Mg、Al都和稀硫酸反应,但Mg失电子的能力大于 Al,所以Mg作负极,Al作正极,负极上Mg失电子变成离子进入溶液,所以电极反应式为:Mg-2e-=Mg2+.正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑;正负极上的电极反应式相加即得电池反应式,所以电池反应式为Mg+H2SO4=MgSO4+H2↑. 故答案为:正极2H++2e-=H2↑ 负极Mg-2e-=Mg2+ 总Mg+H2SO4=MgSO4+H2↑ (2)Al和氢氧化钠溶液反应,Mg和氢氧化钠溶液不反应,Al失电子和氢氧根离子生成偏铝酸根离子和水,即Al-3e-+4 OH-=AlO2-+2 H2O,所以 Al作负极发生氧化反应; Mg作正极,正极上水得电子生成氢气和氢氧根离子,发生还原反应,正极上的电极反应式为 6H2O+6e-=6OH-+3H2↑ 所以电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
相似问题
铜锌原电池(如图)工作时 下列叙述不正确的是A.锌电极上的反应是:Zn-2e-Zn2+B.铜电极上得
铜锌原电池(如图)工作时,下列叙述不正确的是A.锌电极上的反应是:Zn-2e-Zn2+B.铜电极上得到电子,发生还原反应[C.在外电路中,电子从负极流向正
早在1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH 通电 . O2↑+4Na+2H2O;后来
早在1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH通电 O2↑+4Na+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH放电充电
控制适合的条件 将反应Fe2++Ag+Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是A
控制适合的条件,将反应Fe2++Ag+Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是A.反应开始时,电子从甲中石墨经导线流向乙中石墨B.电流计指针
氢氧燃料电池可以使用在航天飞机上 其反应原理示意图如右图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图.下列有关氢氧燃料电池的说法正确的是( )A.该电池的总反应:2H2+O2=2H2OB.该电池中电
普通干电池的电极分别为碳棒和锌筒 以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2 Z
普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e












