粗盐常含有少量Ca2+ Mg2+ SO42-以及泥沙等杂质 实验室提纯NaCl的流程如下:(加入的试
粗盐常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,实验室提纯NaCl的流程如下:(加入的试剂稍过量)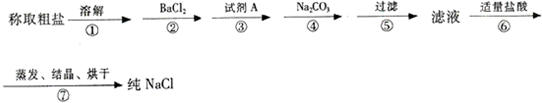 (1)步骤③中加入的试剂A是______(填化学式),除去的离子是______,试剂A稍过量的目的是______,反应的离子方程式______. (2)步骤②、③、④用到的试剂还可以有其他的添加顺序是______(填写化学式). (3)步骤④中,相关的离子方程式______. (4)若将步骤⑤与步骤⑥对调,先用盐酸调pH再过滤,将对实验结果产生的影响是______. (5)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用玻璃棒,其中在蒸发时,使用的目的是______. |
参考解答
| (1)钡离子可除掉硫酸根,A为氢氧化钠,可除掉镁离子:Mg2++2OH-═Mg(OH)2↓,故答案为:NaOH;Mg2+;使Mg2+沉淀完全;Mg2++2OH-═Mg(OH)2↓; (2)除杂试剂为了除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸制不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH),故答案为:BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3; (3)步骤④加入碳酸钠溶液,除去溶液中的钙离子及过量氯化钡引进的钡离子杂质,反应的离子方程式为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓, 故答案为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓; (4)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,故答案为:先加HCl会有少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,从而影响制得NaCl的纯度; (5)在蒸发时,使用玻璃棒进行搅拌,能够受热均匀,可以防止局部过热液滴或晶体飞溅,故答案为:搅拌,防止局部过热液滴或晶体飞溅. |
相似问题
实验室里由粗盐制备精盐的实验中 必需的操作步骤有 [ ] A.溶解 B.过滤 C.分液 D.
实验室里由粗盐制备精盐的实验中,必需的操作步骤有 [ ] A.溶解 B.过滤 C.分液 D.蒸发浓缩
实验室用NaCl固体配制1mol/L的NaCl溶液500mL 回答下列问题:(1)请写出该实验的实验
实验室用NaCl固体配制1mol L的NaCl溶液500mL,回答下列问题:(1)请写出该实验的实验步骤:①计算,②称量,③______,④冷却,⑤______,⑥洗涤,⑦定
某实验小组用下列装置进行乙醇催化氧化的实验。(1)实验过程中铜网出现红色和黑色交替的现象 请写出相应
某实验小组用下列装置进行乙醇催化氧化的实验。(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:___________________、_________
高纯是制备高性能磁性材料的主要原料。实验室以为原料制备少量高纯的操作步骤如下: (1)制备溶液:在烧
高纯是制备高性能磁性材料的主要原料。实验室以为原料制备少量高纯的操作步骤如下: (1)制备溶液:在烧瓶中(装置见下图)加入一定量和水,搅拌,通入
为了除去粗盐中的Ca2+ Mg2+ SO42-及泥沙 可将粗盐溶于水 然后进行下列操作。其正确的操作
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作。其正确的操作顺序是[ ]①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加












