某同学设计实验室利用铝土矿(主要成分Al2O3 还含有Fe2O3 SiO2等)制取氯化铝的方案 过程
| 某同学设计实验室利用铝土矿(主要成分Al2O3,还含有Fe2O3、SiO2等)制取氯化铝的方案,过程如下 |
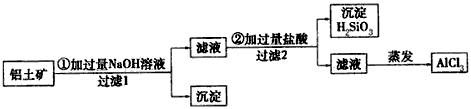 |
| (1)用化学式表示过滤1得到的沉淀是______________。 (2)写出步骤②中发生反应的离子方程式:___________。 (3)蒸发AlCl3溶液提取AlCl3需要在HCl气氛中进行,理由是_________________________。 (4)实验证明,熔融的AlCl3不导电,推测其原因是:_________________________最新报道工业采用电解 AlCl3-NaCl熔盐制铝工艺,试写出该电解反应的化学方程式________________________ 。研究证实该熔盐体系中,铝元素以AlCl4-和Al2Cl7-离子的形式存在,则在此工艺中NaCl的作用是__________________ (5)铝是一种重要的金属,下列关于铝的叙述中不正确的是___________(填序号)。 A.铝元素在地壳中含量虽比铁高,但金属铝的使用较晚 B.铝热反应可用于冶炼金属,尤其可以冶炼一些难熔金属 C.铝燃烧时会放出大量的热,可以作为一种生活能源 D.镁和铝与氢氧化钠溶液能形成原电池,在镁电极表面有气体产生 E.用铝板和铂网做电极,以海水为电解质溶液可以制成海洋电池 |
参考解答
| (1)Fe2O3 (2)OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓ (3)AlCl3发生水解AlCl3+3H2O  Al(OH)3+3HCl,蒸发时由于HCl挥发最终得不到无水AlCl3而是氢氧化铝(或氧化铝),若在HCl气氛中进行蒸发可以抑制AlCl3的水解 Al(OH)3+3HCl,蒸发时由于HCl挥发最终得不到无水AlCl3而是氢氧化铝(或氧化铝),若在HCl气氛中进行蒸发可以抑制AlCl3的水解(4)AlCl3在熔融状态下不发生电离,没有产生自由移动的离子;2AlCl3  2Al+3Cl2↑;做溶剂,使铝元素在其中形成AlCl4-和Al2Cl7-(配离子) 2Al+3Cl2↑;做溶剂,使铝元素在其中形成AlCl4-和Al2Cl7-(配离子)(5)C |
相似问题
实验室可用NaBr 浓H2SO4 乙醇为原料制备少量溴乙烷: C2H5-OH+HBrC2H5Br+H
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷: C2H5-OH+HBrC2H5Br+H2O 已知反应物的用量为:0 30 mol NaBr(s);0 25 mol C2H5OH(密度为
某工厂有废合金(含有铝 铁 铜)粉末 甲同学探索工业废料的利用 用该废合金粉末制取纯净的氯化铝溶液
某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下试回答下
制取一氯乙烷最好的方法是 [ ]A.乙烷和氯气反应 B.乙烯和氯气反应 C.乙烯和氯化氢反应
制取一氯乙烷最好的方法是 [ ]A.乙烷和氯气反应 B.乙烯和氯气反应 C.乙烯和氯化氢反应 D.乙烯和氢气、氯气加成
一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH3)4]SO4·H2O 是一种重要的染料及农药中间体
一水硫酸四氨合铜(Ⅱ)的化学式为[ Cu( NH3)4]SO4·H2O,是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成
CaCO3广泛存在于自然界 是一种重要的化工原料。大理石主要成分为CaCO3 另外有少量的含硫化合物
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用












