在一个2L的密闭容器中 发生反应2SO3(g)?2SO2(g)+O2(g);△H>0 其中SO3的变
| 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: (1)写出该反应的平衡常数表达式______. (2)用O2表示0~8min内该反应的平均速率v=______. (3)升高温度,该反应的反应速率将______;K值将______;容器中气体的平均相对分子质量将______.(填“增大”“减小”或“不变”) (4)能说明该反应已达到平衡状态的是______ a.v(SO3)=2v(O2) b.容器内压强保持不变 c.v逆(SO2)=2v正(O2) d.容器内密度保持不变 (5)从8min起,压缩容器为1L,则SO3的变化曲线为______ A. a B. b C. c D. d. 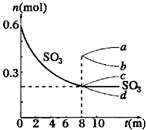 |
参考解答
(1)该反应的平衡常数表达式为K=
(2)根据v=
故答案为:0.0125mol/(L?min); (3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;增大;减小; (4)a、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误; b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确; c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故c正确; d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误; 故答案为:b、c; (5)容器的体积减小,压强增大,平衡向逆反应方向移动,SO3的物质的量增多,故答案为:c. |
相似问题
在恒温容器中 可逆反应 C(s)+H2O(g)?CO(g)+H2(g)一定达平衡状态的是( )A.
在恒温容器中,可逆反应C(s)+H2O(g)?CO(g)+H2(g)一定达平衡状态的是( )A.气体的压强不变B.气体的体积不变C.混合气的密度不变D.有n个H-O
将4mol A 气体和2mol B 气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经2s后测得C的浓度为0 6mol L,现有下列几种说法,其中正
一定温度下 在恒容密闭容器中 能说明可逆反应:H2(g)+I2(g)2HI(g)已达到平衡状态的是①
一定温度下,在恒容密闭容器中,能说明可逆反应:H2(g)+I2(g)2HI(g)已达到平衡状态的是①单位时间内生成nmolH2的同时生成2nmolHI②c(H2):c(I2
已知2A(g)+B(g)?2C(g) 向容积为1L的密闭容器中加入0.050molA和0.025mo
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0 050molA和0 025molB,在500℃时充分反应,达平衡后测得c(C)=0 040mol.L-1,放出热量Q1kJ.
下列对于反应C(s)+H2O(g)CO(g)+H2(g)的描述正确的是 [ ]A.达到平衡时
下列对于反应C(s)+H2O(g)CO(g)+H2(g)的描述正确的是 [ ]A.达到平衡时,各反应物和生成物浓度相同B.增大压强,对此反应速率无影响C.达到平












